题目内容
【题目】A、B、C、D、E均为中学化学的常见单质或化合物,它们之间的反应关系如图所示:
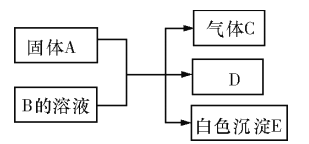
(1)若A是短周期中原子半径最大的元素构成的单质,E 既可溶于盐酸又可溶于NaOH ,E 溶于NaOH 溶液的离子方程式为___________;工业上冶炼A 的化学反应方程式为_________________。
(2)若A为红色金属,B 为某酸的浓溶液,C 为可形成酸雨的无色气体。则A 与B反应的化学方程式为___________________________。
(3)若B为某酸式盐的溶液,C 是既含有极性键又含有非极性键的四原子分子,则实验室制取C的化学方程式为 _________________;0.1molC 完全燃烧生成液态水时放热130kJ·mol-1,则表达C 燃烧热的热化学方程式是_______________。
【答案】 Al(OH)3+OH-==AlO-2+2H2O 2NaCl(熔融)![]() 2Na+Cl2↑ Cu+2H2SO4(浓)
2Na+Cl2↑ Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O CaC2+2H2O→C2H2↑+Ca(OH)2 C2H2(g)+
CuSO4+SO2↑+2H2O CaC2+2H2O→C2H2↑+Ca(OH)2 C2H2(g)+![]() O2(g)→2CO2(g)+H2O(l) △H=-1300kJ·mol-1
O2(g)→2CO2(g)+H2O(l) △H=-1300kJ·mol-1
【解析】(1)A是短周期中原子半径最大的元素构成的单质,应为Na,E既可溶于盐酸又可溶于NaOH溶液,应为Al(OH)3,Al(OH)3与NaOH溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,工业冶炼Na用电解熔融的NaCl的方法,反应的化学方程式为2NaCl(熔融)![]() 2Na+Cl2↑,故答案为:Al(OH)3+OH-=AlO2-+2H2O;2NaCl(熔融)
2Na+Cl2↑,故答案为:Al(OH)3+OH-=AlO2-+2H2O;2NaCl(熔融)![]() 2Na+Cl2↑;
2Na+Cl2↑;
(2)若A为红色金属,B 为某酸的浓溶液,C 为可形成酸雨的无色气体。则A为铜,C为二氧化硫,铜与浓硫酸反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(3)既含有极性键又含有非极性键的四原子分子有C2H2或H2O2,其中能燃烧的是C2H2,则A为CaC2,与水反应生成C2H2和Ca(OH)2,与B的溶液反应生成C2H2、水和碳酸钙,则B为Ca(HCO3)2,1molC2H2完全燃烧生成液态水时放热1300kJ,则2molC2H2完全燃烧放出2600kJ的热量,所以完全燃烧的热化学方程式为2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2600kJmol-1,因此燃烧热的热化学方程式为C2H2(g)+ ![]() O2(g)→2CO2(g)+H2O(l) △H=-1300kJ·mol-1,故答案为:C2H2(g)+
O2(g)→2CO2(g)+H2O(l) △H=-1300kJ·mol-1,故答案为:C2H2(g)+ ![]() O2(g)→2CO2(g)+H2O(l) △H=-1300kJ·mol-1。
O2(g)→2CO2(g)+H2O(l) △H=-1300kJ·mol-1。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:
___________________________________________________________。
(2)装置B中饱和食盐水的作用是_______________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象___________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______。
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为______色,说明氯的非金属性大于溴。
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是_____________。
(6)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:__________________,判断改用NaHSO3溶液是否可行______(填“是”或“否”)。

