题目内容
3.某课外小组分别用下图所示装置对原电池和电解原理进行实验探究:
请回答:
I.用图1所示装置进行第一组实验
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是A(填字母序号).
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为2H++2e-═H2↑.
II.用图2所示装置进行第二组实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.(查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.)
(3)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-═FeO42-+4H2O 和4OH--4e-═2H2O+O2↑.
(4)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少0.28 g.
分析 Ⅰ.图1中,左边装置是原电池,较活泼的金属锌作负极,较不活泼的金属铜作正极,如果要找电极材料代替铜,所找材料必须是不如锌活泼的金属或导电的非金属,M是阳极,N是阴极,电解池中阴极上阳离子得电子发生还原反应,原电池放电时,阴离子向负极移动;
(1)在保证电极反应不变的情况下,仍然是锌作负极,则正极材料必须是不如锌活泼的金属或导电的非金属;
(2)N电极是电解池的阴极氢离子得到电子生成氢气;
Ⅱ.该电解池中,阳极材料是活泼金属,则电解池工作时,阳极上铁失电子发生氧化反应,同时氢氧根离子失电子生成氧气,阴极上氢离子得电子发生还原反应,根据阴阳极上转移电子数相等计算铁反应的质量,在碱性锌电池中,正极上得电子发生还原反应;
(3)铁是活泼金属,电解池工作时,阳极上铁失电子发生氧化反应,氢氧根离子失电子发生氧化反应;
(4)根据阴阳极上转移电子数相等计算铁反应的质量.
解答 解:I.(1)在保证电极反应不变的情况下,仍然是锌作负极,则正极材料必须是不如锌活泼的金属或导电的非金属,铝是比锌活泼的金属,所以不能代替铜;
故答案为:A;
(2)N电极连接原电池负极,所以是电解池阴极,阴极上氢离子得电子发生还原反应,电极反应式为:2H++2e-═H2↑,
故答案为:2H++2e-═H2↑;
II.(3)铁是活泼金属,电解池工作时,阳极上铁失电子发生氧化反应,氢氧根离子失电子发生氧化反应,所以发生的电极反应式为:Fe-6e-+8OH-═FeO42-+4H2O和4OH--4e-═2H2O+O2↑,
故答案为:4OH--4e-═2H2O+O2↑;
(4)X电极上析出的是氢气,Y电极上析出的是氧气,且Y电极失电子进入溶液,
设铁质量减少为xg,
根据转移电子数相等得$\frac{0.672L}{22.4L/mol}$×2=$\frac{0.168L}{22.4L}$×4×$\frac{xg}{56g/mol}×6$,x=0.28;
故答案为:0.28g.
点评 本题考查了原电池和电解池原理,注意:电解池中如果活泼金属作阳极,则电解池工作时阳极材料失电子发生氧化反应,为易错点,注意电子守恒在计算中的应用,题目难度中等.

 氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO3-+3HSO3-═3SO42-+Cl-+3H+.已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )
氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO3-+3HSO3-═3SO42-+Cl-+3H+.已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )| A. | 反应开始时速率增大可能是c(H+)所致 | |
| B. | 纵坐标为v(Cl-)的v-t曲线与图中曲线完全重合 | |
| C. | 图中阴影部分的面积表示t1-t2时间内ClO3-的物质的量的减少量 | |
| D. | 后期反应速率下降的主要原因是反应物浓度减少 |
| A. | 阴离子的半径按X、Y、Z的顺序增大 | |
| B. | 元素非金属性按X、Y、Z的顺序增强 | |
| C. | 气态氢化物的稳定性按X、Y、Z的顺序增强 | |
| D. | 单质的氧化性按X、Y、Z的顺序增强 |
| A. | ①②③⑤ | B. | ④⑥⑦ | C. | ①④⑥⑦ | D. | ①⑤⑥ |
| A. | 向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 向水中加入少量CH3COOH,水的电离平衡逆向移动,c(H+)降低 | |
| D. | 将水加热,Kw增大,pH不变 |
| A. | 18 g H2O中含有2 mol氢 | |
| B. | 阿伏加德罗常数是指0.012 kg碳所含有的碳原子数,其数值约等于6.02×1023 | |
| C. | 铁的摩尔质量及其相对原子质量均为56 g•mol-1 | |
| D. | 常温常压下,44 g CO2气体与46 g N2O4气体具有相同数目的氧原子 |


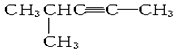 分子式为C5H8,名称是4-甲基-1-戊炔,
分子式为C5H8,名称是4-甲基-1-戊炔,