��Ŀ����
5��ʵ������Ũ�����MnO2��Cl2������Cl2��Ϊԭ�Ͻ���ʵ�飬װ����ͼ��ʾ��
��1��װ��A��ƿ�з�����Ӧ�Ļ�ѧ����ʽΪMnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��
��2��װ��B��C��Ӧʢ�ŵ��Լ����Ʒֱ�Ϊ����ʳ��ˮ��Ũ�����Aװ�õ�����������������B��Cװ�ö�ֱ�ӽ���D�ܣ�����ʵ������IJ��������δ����ȥ���Ȼ����ˮ��������������D�к����ܷ�Ӧ����������������������ϻᷢ����ը��
��3��ʵ��ʱ���ȵ�ȼA���ľƾ��ƣ�����������װ�ã��ٵ�ȼD���ƾ��ƣ�д��D�з�Ӧ�Ļ�ѧ����ʽ2Fe+3Cl2$\frac{\underline{\;\;��\;\;}}{\;}$2FeCl3��
��4��Fװ����������������ն������������ֹ��Ⱦ��������ֹ�����е�ˮ��������D�У�
��5�������۵�ʯ���������������Ƶ�Ư�۾���д����ҵ��Ư�۾���Ӧ�Ļ�ѧ����ʽ2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��
��6��ʵ����Ҳ��������������ᷴӦ�Ʊ���������ʹ��K37ClO3��H35Cl�Ʊ�ʱ������������ƽ����Է���������70.67����ȷ��0.01��
���� ��1������������Ũ�����ڼ��������·�Ӧ�����Ȼ��̺�������ˮ��
��2��Ũ������лӷ��ԣ����Ի�������к����Ȼ����ˮ������Ȼ����ݳ���Ҫ����������������к����Ȼ����ˮ����������D���Ȼ�������ܷ�Ӧ����������������������ϻᷢ����ը���ݴ��жϣ�
��3�������������ڼ��������·�Ӧ�����Ȼ�����
��4���������������ʺͼ�ʯ�ҵijɷ��жϣ�
��5��������ʯ���鷴Ӧ�����Ȼ��ơ�������ƺ�ˮ��
��6�����ݷ���ʽK37ClO3+6H35Cl=K35Cl+35Cl37Cl��+35Cl2��+3H2O�����ƽ����Է����������㷽�����
��� �⣺��1������������Ũ�����ڼ��������·�Ӧ�����Ȼ��̺�������ˮ������ʽΪMnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��
�ʴ�Ϊ��MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��
��2��Ũ������лӷ��ԣ����Ի�������к����Ȼ��⣬�Ȼ��⼫������ˮ�����������ڱ���ʳ��ˮ������ѡ����ʳ��ˮ��ȥ�Ȼ��⣻������Ҫ����ȡ��������ˮAlCl3������Ҫ��ȥ�����л��е�ˮ�������Ҳ������µ����ʡ�����Ҳ�����ʲ���Ӧ������ѡŨ���
��Ũ������лӷ��ԣ���Ӧ����������ˮ���ڼ��������±��ˮ���������Ի�������еijɷ����Ȼ��⡢ˮ�������������Ȼ�������ܷ�Ӧ����������������������ϻᷢ����ը��
�ʴ�Ϊ������ʳ��ˮ��Ũ���δ����ȥ���Ȼ����ˮ��������������D�к����ܷ�Ӧ����������������������ϻᷢ����ը��
��3�������������ڼ��������·�Ӧ�����Ȼ���������ʽ��2Fe+3Cl2$\frac{\underline{\;\;��\;\;}}{\;}$2FeCl3��
�ʴ�Ϊ��2Fe+3Cl2$\frac{\underline{\;\;��\;\;}}{\;}$2FeCl3��
��4�������ж�����Ⱦ���������Բ����ſգ���ʯ�ҵijɷ��������ƺ��������ƣ������������ơ����������ܷ�Ӧ�ﵽ�����Կ��ü�ʯ�Ҵ���β������������ˮ��������ʯ�һ�������ˮ���������Կ����������
�ʴ�Ϊ�����ն������������ֹ��Ⱦ��������ֹ�����е�ˮ��������D�У�
��5���������������Ʒ�Ӧ�����Ȼ��ơ�������ƺ�ˮ����Ӧ����ʽΪ��2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��
�ʴ�Ϊ��2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��
��6��K37ClO3+6H35Cl=K35Cl+35Cl37Cl��+235Cl2��+3H2O����Ӧ��������һ��35Cl37Cl������35Cl2����������ƽ����Է���������$\frac{35+37+35��4}{4}$=70.67��
�ʴ�Ϊ��70.67��
���� ���⿼���������ʵ�����Ʒ�����Ӧԭ�������ʵ����ʣ���Ŀ�Ѷ��еȣ������ڿ���ѧ����ʵ�������ͶԻ���֪ʶ���ۺ�Ӧ��������

 ��ս100��Ԫ����Ծ�ϵ�д�
��ս100��Ԫ����Ծ�ϵ�д�
| A�� | װ�â�������ʢװ����ŨH2SO4����ˮ | |
| B�� | ʵ��ʱ��Ӧ�ȼ��ȹ�ʽ¯���ٴ�ʢװϡ����ķ�Һ©�� | |
| C�� | Ϊ�����ƵõĹ����Ƿ��������ʣ���Ҫ�õ����Լ�Ϊ���ᡢ˫��ˮ�����軯����Һ | |
| D�� | ��ʵ�����Ʊ�������װ��Ҳ��������������ϡ��Һ���Ȼ�粒��巴Ӧ�Ʊ����� |
| A�� | ���������ݻ����䣬�����м���1 mol H2��g�����ٽ�ƽ��ʱ��Ӧ����һ���ӿ� | |
| B�� | ���������ݻ����䣬�����м���1 mol N2��N2���μӷ�Ӧ������Ӧ����һ���ӿ� | |
| C�� | ��������������ѹǿ���䣬�����м���1 mol N2��N2���μӷ�Ӧ�����ٴ�ƽ��ʱ��Ӧ����һ���ӿ� | |
| D�� | ��������������ѹǿ���䣬�����м���1 mol H2��g����1 mol I2��g�����ٴ�ƽ��ʱ��Ӧ����һ���ӿ� |
| A�� | ±�ص��ʵ��۵㰴F2��Cl2��Br2��I2��˳�����μ�С | |
| B�� | ±�ص������������ϰ�F2��Cl2��Br2��I2��˳�����ѱ��� | |
| C�� | ±��������ɫ��AgCl��AgBr��AgI����˳�����μ��� | |
| D�� | ±����Ļ�ԭ��HF��HCl��HBr��HI��˳�����μ��� |
| Ԫ�ش��� | L | M | X | R | T |
| ԭ�Ӱ뾶/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| ��Ҫ���ϼ� | +2 | +3 | +6��-2 | +2 | -2 |
��R���������Ӧ��ˮ������ܾ�������
��X���ʿ���������ȼ������XO3
�����Ӱ뾶��С��r��M3+����r��T2-��
��L2+��X2-�ĺ����������ȣ�
| A�� | �٢� | B�� | �٢� | C�� | �ڢ� | D�� | �٢ڢ� |
��1����̫���ܽ�CO2ת����O2��C��ʯīϩ������������ͼ1��
��Fe3O4��Fe�Ļ��ϼ���+2��+3��
������ϵͳ������Ӧ�Ļ�ѧ����ʽΪ6FeO+CO2�T2Fe3O4+C��
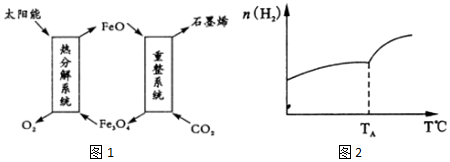
��2��������̼�������ڴ��������¿���ȡ��̼ϩ������һ�ܱ������зֱ�Ͷ��1molCO2��3molH2��������Ӧ��2CO2��g��+6H2��g��?C2H4 ��g��+4H2O��g����H���ڲ�ͬ�¶��£��ô��м������ƽ��ʱH2�����ʵ����仯��ϵ��ͼ2��ʾ��
�������������䣬��ʼʱ����lmolCO2��2molH2����Ͷ�ϣ�CO2ת���ʽ���С�����������С�����䡱����
�ڡ�H��0�������������������ȷ��������
������������ϵ���������������Խ��ͼʾ�ƶ����ȶ���C2H4��H2O �������������������ȷ��������
��3���ð�ˮ����CO2�ƻ��ʣ�NH4HCO3��
����֪��NH3•H2O��aq��?NH4+��aq��+OH-��aq����H1=a kJ•mol-1
CO2 ��g��+H2O��l��?H2CO3 ��aq����H2=bkJ•mol-1
H2CO3��aq��+OH-��aq��?HCO3-��aq��+H2O��l����H3=ckJ•mol-1
������NH3•H2O����CO2�Ʊ�NH4HCO3���Ȼ�ѧ����ʽΪNH3•H2O+CO2�TNH4++HCO3-��H=��a+b+c��kJ/mol��
����֪������������������
| Kb��NH3•H2O�� | 2��10-5mol•L-1 |
| Ka1��H2CO3�� | 4��10-7mol•L-1 |
| Ka2��H2CO3�� | 4��10-11mol•L-1 |





 �������E������D������A������ĸ��������װ��E��������i�۲������ͨ�����ʢ���������͵�������ȥ�����е��Ȼ���
�������E������D������A������ĸ��������װ��E��������i�۲������ͨ�����ʢ���������͵�������ȥ�����е��Ȼ���