题目内容
12.25℃时,下列叙述正确的是( )| A. | 向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 向水中加入少量CH3COOH,水的电离平衡逆向移动,c(H+)降低 | |
| D. | 将水加热,Kw增大,pH不变 |
分析 A.由于加入了氨水,溶液中氢氧根离子浓度增大;
B.硫酸氢钠在溶液中电离出氢离子,导致氢离子浓度增大;水的离子积与与温度有关;
C.加入醋酸中溶液中氢离子浓度增大;
D.加热水后氢离子浓度增大,溶液的pH减小.
解答 解:A.向水中加入稀氨水,抑制了水的电离,水的电离平衡逆向移动,但溶液中c(OH-)增大,故A错误;
B.硫酸氢钠能够电离出氢离子,向水中加入少量固体硫酸氢钠,溶液中c(H+)增大,由于温度不变,则水的离子积Kw不变,故B正确;
C.向水中加入少量CH3COOH,抑制了水的电离,水的电离平衡逆向移动,由于醋酸电离出氢离子,导致溶液中c(H+)增大,故C错误;
D.水的电离为吸热反应,将水加热后水的电离程度增大,则水的离子键Kw增大,由于氢离子浓度增大,水的pH减小,故D错误;
故选B.
点评 本题考查水的电离及其影响,题目难度不大,明确弱电解质的电离平衡及其影响为解答关键,注意掌握溶液酸碱性对水的电离程度的影响,试题培养了学生的分析能力及综合应用能力.

练习册系列答案
相关题目
2.二氯化碳利用具有十分重要的意义,科学家有以下几个设想.
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如图1:
①Fe3O4中Fe的化合价是+2和+3;
②重整系统发生反应的化学方程式为6FeO+CO2═2Fe3O4+C.
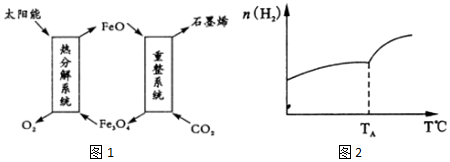
(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃.在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)?C2H4 (g)+4H2O(g)△H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图2所示.
①其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将减小(填“增大”、“减小”或“不变”);
②△H<0(填“>”“<”“不能确定”).
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4<H2O (填“>”“<”“不能确定”).
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3•H2O(aq)?NH4+(aq)+OH-(aq)△H1=a kJ•mol-1
CO2 (g)+H2O(l)?H2CO3 (aq)△H2=bkJ•mol-1
H2CO3(aq)+OH-(aq)?HCO3-(aq)+H2O(l)△H3=ckJ•mol-1
则利用NH3•H2O吸收CO2制备NH4HCO3的热化学方程式为NH3•H2O+CO2═NH4++HCO3-△H=(a+b+c)kJ/mol;
②已知常温下相关数据如表:
则反应NH4++HCO3-+H2O?NH3•H2O+H2CO3的平衡常数k=1.25×10-3.
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如图1:
①Fe3O4中Fe的化合价是+2和+3;
②重整系统发生反应的化学方程式为6FeO+CO2═2Fe3O4+C.

(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃.在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)?C2H4 (g)+4H2O(g)△H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图2所示.
①其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将减小(填“增大”、“减小”或“不变”);
②△H<0(填“>”“<”“不能确定”).
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4<H2O (填“>”“<”“不能确定”).
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3•H2O(aq)?NH4+(aq)+OH-(aq)△H1=a kJ•mol-1
CO2 (g)+H2O(l)?H2CO3 (aq)△H2=bkJ•mol-1
H2CO3(aq)+OH-(aq)?HCO3-(aq)+H2O(l)△H3=ckJ•mol-1
则利用NH3•H2O吸收CO2制备NH4HCO3的热化学方程式为NH3•H2O+CO2═NH4++HCO3-△H=(a+b+c)kJ/mol;
②已知常温下相关数据如表:
| Kb(NH3•H2O) | 2×10-5mol•L-1 |
| Ka1(H2CO3) | 4×10-7mol•L-1 |
| Ka2(H2CO3) | 4×10-11mol•L-1 |
20.除去乙酸乙酯中残留的乙酸和乙醇,有效的处理方法是( )
| A. | 蒸馏 | B. | 水洗后分液 | ||
| C. | 用过量饱和碳酸钠溶液洗涤后分液 | D. | 用过量氯化钠溶液洗涤后分液 |
7. 某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连.下列有关说法中错误的是( )
某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连.下列有关说法中错误的是( )
 某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连.下列有关说法中错误的是( )
某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连.下列有关说法中错误的是( )| A. | X原子可能为VA族元素 | |
| B. | Y原子一定为IA族元素 | |
| C. | 该分子中,既含极性键,又含氢键 | |
| D. | 从圆球的大小分析,该分子可能为N2F4 |
17.实验室进行粗盐提纯,无需进行的操作是( )
| A. | 分液 | B. | 溶解 | C. | 过滤 | D. | 蒸发 |
4.与氩核外电子排布相同的离子,跟与氖核外电子排布相同的离子,所形成化合物是( )
| A. | CaF2 | B. | HCl | C. | Na2O | D. | H2O |
1.下列说法正确的是( )
| A. | 反应物分子的每次碰撞都能发生化学反应 | |
| B. | 活化分子之间的碰撞一定是有效碰撞 | |
| C. | 能够发生化学反应的碰撞是有效碰撞 | |
| D. | 增大反应物浓度时,活化分子百分数增大 |
