题目内容
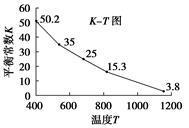
碘在水中溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I-(aq)=I3-.已知在不同温度下该反应的平衡常数如图,下列说法不正确的是( )
| A.上述反应正反应为放热反应 |
| B.实验室配制碘水,为增大碘的溶解度可加入少量的KI |
| C.用该反应原理可除去硫粉中少量的碘单质 |
| D.上述体系中加入苯,平衡不移动 |

A、由图象曲线的变化趋势可知,当温度升高时,I3-的物质的量浓度减小,说明该反应的正反应为放热反应,反应I2(aq)+I-(aq)

I3-(aq)的△H<0,故A正确;
B、因为发生反应:I2(aq)+I-(aq)=I3-.增大了碘的溶解度,所以配制碘水加入少量碘化钾,当消耗碘单质时平衡左移又生成碘单质,故B正确;
C、硫不溶于KI溶于,碘在水中溶解度很小,但易溶于KI溶液,因此可以分离,故C正确;
D、苯会萃取水中的碘,使碘浓度下降,平衡逆向移动,故D错误;
故选D.

I3-(aq)的△H<0,故A正确;
B、因为发生反应:I2(aq)+I-(aq)=I3-.增大了碘的溶解度,所以配制碘水加入少量碘化钾,当消耗碘单质时平衡左移又生成碘单质,故B正确;
C、硫不溶于KI溶于,碘在水中溶解度很小,但易溶于KI溶液,因此可以分离,故C正确;
D、苯会萃取水中的碘,使碘浓度下降,平衡逆向移动,故D错误;
故选D.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
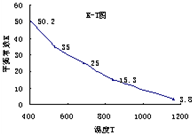 (2009?茂名二模)碘在水中溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I-(aq)=I3-.已知在不同温度下该反应的平衡常数如图,下列说法不正确的是( )
(2009?茂名二模)碘在水中溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I-(aq)=I3-.已知在不同温度下该反应的平衡常数如图,下列说法不正确的是( )