题目内容
碘在水中溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I-(aq)===I3- (aq)。已知在不同温度下该反应的平衡常数如图:
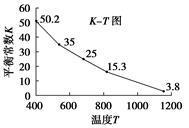
下列说法不正确的是( )
A.上述反应正反应为放热反应
B.实验室配制碘水,为增大碘的溶解度可加入KI
C.用该反应原理可除去硫粉中少量的碘单质
D.上述体系中加入苯,平衡不移动
【答案】
D
【解析】
试题分析:根据图像可知,随着温度的升高,平衡常数逐渐减小,这说明升高温度平衡向逆反应方向移动,所以正反应是放热反应,A正确。由题意知B、C正确;加入苯起到萃取作用,使I2进入有机层,降低其浓度,平衡向逆反应方向移动,D不正确,答案选D。
考点:考查反应热、平衡常数阳极外界条件对平衡状态的影响
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查。试题难易适中,综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和应试能力。

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
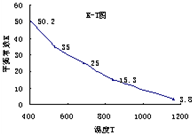 (2009?茂名二模)碘在水中溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I-(aq)=I3-.已知在不同温度下该反应的平衡常数如图,下列说法不正确的是( )
(2009?茂名二模)碘在水中溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I-(aq)=I3-.已知在不同温度下该反应的平衡常数如图,下列说法不正确的是( )
