题目内容
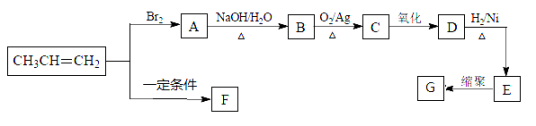
【题目】工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:

已知:
物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | NaCl |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 801 |
回答下列问题:
(1)高温反应前,常在800℃焙烧铝土矿,使固体中水分挥发、气孔数目增多,其作用是 ___(只要求写出一种)。
(2)高温反应后,铝土矿中的氧化物均转变为相应的氯化物,由Al2O3、C和Cl2反应生成AlCl3的化学方程式为 。
(3)气体II的主要成分除了Cl2外,还含有 。气体II常用过量冷的NaOH溶液吸收,吸收液中含有的阴离子主要有 。
(4)工业上为了降低生产成本,生产过程中需要控制加入铝粉的量,“废渣”的主要成分是 。
(5)AlCl3和NaCl的熔融盐常用于镀铝电解池,电镀时AlCl-4和Al2Cl-7两种离子在电极上相互转化,其它离子不参与电极反应,电镀时阴极的电极反应式为 。
【答案】(1)增大固体表面积,加快反应速率(或除去水,高温下生成的AlCl3水解)
(2)Al2O3+3C+3Cl2![]() 2AlCl3+3CO
2AlCl3+3CO
(3)CO、SiCl4;Cl-、ClO-、SiO32-、OH-
(4)FeCl2、NaCl
(5)4Al2Cl7-+3e-=Al+7AlCl4-
【解析】
试题分析:根据题给化学工艺流程分析,铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)在950℃下,与足量焦炭、Cl2和O2反应生成气体Ⅰ:AlCl3、 FeCl3 、SiCl4和CO;将气体Ⅰ在100℃下冷凝,结合题给物质的沸点数据知气体Ⅱ的成分为Cl2、SiCl4和CO,固体为氯化铝和氯化铁的混合物;为防止氯化铝和氯化铁的升华,向固体中加入氯化钠,熔化的氯化铁、氯化铝和氯化钠的液态混合物;为防止氯化铁的升华,向液态混合物中加入适量铝粉,氯化铁转化为氯化亚铁,冷却,然后在300℃下升华得氯化铝成品,废渣为氯化钠和氯化亚铁。据此作答。
(1)高温反应前,在800℃焙烧铝土矿,使固体中水分挥发、气孔数目增多,其作用是增大固体表面积,加快反应速率(或除去水,防止高温下生成的AlCl3水解)。
(2)高温下,由Al2O3、C(足量)和Cl2反应生成AlCl3和CO,化学方程式为
Al2O3+3C+3Cl2![]() 2AlCl3+3CO。
2AlCl3+3CO。
(3)气体II的主要成分除了Cl2外,还含有CO、SiCl4。气体II常用过量冷的NaOH溶液吸收,发生的反应为:Cl2+2NaOH ==NaCl+NaClO+H2O、SiCl4+6NaOH ==Na2SiO3+NaCl+3H2O,吸收液中含有的阴离子主要有Cl-、ClO-、SiO32-、OH-。
(4)液体混合物中加入适量铝粉,发生反应:Al+3FeCl3==AlCl3+3FeCl2,“废渣”的主要成分是FeCl2、NaCl。
(5)AlCl3和NaCl的熔融盐常用于镀铝电解池,电镀时阴极发生还原反应生成铝单质,电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-。

 阅读快车系列答案
阅读快车系列答案【题目】硫酸性质是中学化学学习的重点。请回答下列问题:
(1)中学化学中利用物质与浓硫酸共热可制备SO2气体,写出用浓硫酸还可制备不同类别的气体的名称: (写一种)。
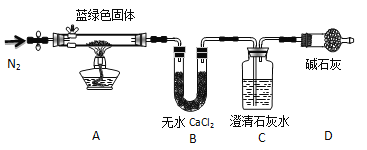
(2)某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用下图所示装置进行有关实验。

①装置B的作用是贮存多余的气体。B中应放置的液体是_______(填序号)。
a.饱和Na2SO3溶液 b.酸性 KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
②反应完毕后,烧瓶中还有一定量的余酸,使用足量的下列药品不能用来证明反应结束后的烧瓶中的确有余酸的是____ (填序号)。
a.Fe粉 b.BaCl2溶液 c.CuO d.Na2CO3溶液
③实验中某学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,该反应的化学方程式是______ ____。
④为验证二氧化硫的还原性,C中盛有氯水,充分反应后,取C中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”或“Ⅲ”);C中发生反应的离子方程式为 。D中盛有氢氧化钠溶液,当通入二氧化硫至试管D中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
(3)利用FeCl3溶液的氧化性也可以吸收SO2。
①该反应的离子方程式是 。检验FeCl3是否完全被还原的方法为 。
②为验证FeCl3溶液与SO2的反应:同学们将SO2通入0.05 mol·L-1 FeCl3溶液中, 溶液很快由黄色变为红褐色; 将溶液长时间放置后, 最终变为浅绿色。 关于红褐色液体, 以下是同学们的分析推测及实验。
分析推测 | 实验步骤及现象 |
甲: 生成了Fe(OH) 3胶体 乙: 经查阅资料, 可能发生反应: Fe3++6SO2 | ⅰ. 制备Fe(OH) 3胶体并检验 ⅱ. 分别向Fe(OH) 3胶体和该红褐色液体中加入适量铁粉, 振荡后前者不变色, 后者变为浅绿色 |
利用胶体的 (填性质) 可以检验步骤ⅰ中是否得到了Fe(OH) 3胶体。
根据反应b, 说明步骤ⅱ中液体颜色变化的原因是 (用离子方程式结合必要的文字说明) 。