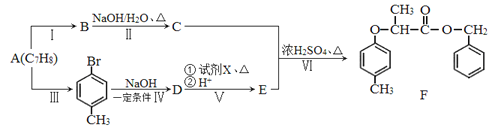
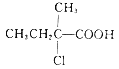
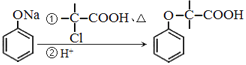题目内容
【题目】
(1)为测定一种气态烃A的化学式,取标准状况下一定体积的A置于密闭容器中,再通入一定体积的O2 , 用电火花引燃,定性实验表明产物是CO2、CO和水蒸气。相关方案如下:(箭头表示气体流向,实验前系统内空气已排除)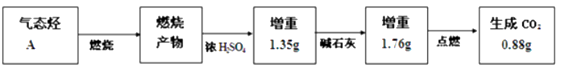
试回答(不要求写计算过程):A的实验式(最简式)是 , 根据所学知识,气态烃A的分子式为。
(2)质子核磁共振(PMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一个结构中的等性氢原子的PMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中的等性氢原子数成正比。现有某有机物,化学式为C6H12。已知该物质可能存在多种结构,a、b、c是其中的三种,请根据下列要求填空:
①a与氢气加成生成2―甲基戊烷,则a的可能结构有种。
②b能使溴水和酸性高锰酸钾褪色,PMR谱中只有一个信号,则b的结构简式为: , 其命名为:。
③c不能使酸性高锰酸钾溶液褪色,不能与溴水加成褪色,可萃取溴水中的溴;PMR谱中也只有一个信号,则c的结构简式为:。
【答案】
(1)C2H5,C4H10
(2) 4, ,2,3-二甲基-2-丁烯,
,2,3-二甲基-2-丁烯,![]()
【解析】解:(1)根据整个流程图提供的数据可知,烃A的三种燃烧产物的物质的量分别为:n(H2O)=1.35/18=0.075 mol n(CO2)=1.76/44=0.04 mol n(CO)=0.88/44=0.02 mol,所取A中含C原子的物质的量为:n(C)=0.04 mol+0.02 mol=0.06 mol;含氢原子的物质的量为:n(H)=0.075 mol×2=0.15 mol;C、H 原子个数比为C:H=0.06:0.15=2:5,所以烃A的实验式为C2H5,根据实验式,设烃A的分子式为C2nH5n,n=1时,烃A的分子式为C2H5,这种烃不存在,n=2时,烃A的分子式为C4H10,为丁烷,此时烃分子中的氢原子数已达到饱和,所以烃A只能是丁烷,分子式为C4H10。(2)①化学式为C6H12的一种同分异构体a与氢气加成生成2―甲基戊烷的结构简式为CH3CH(CH3)CH2CH2CH3,该分子将相邻碳原子上的氢原子去掉一个组成烯烃,一共能形成4个烯烃,所以a的可能结构有4种;
②b能使溴水和酸性高锰酸钾褪色,说明该烃是烯烃,PMR谱中只有一个信号,说明该分子高度对称,分子中的氢原子都是等效氢原子,则b的结构简式为:(CH3)2—C=C—(CH3)2,根据有机物的命名,该有机物的名称为2,3—二甲基—2—丁烯。
③c不能使酸性高锰酸钾溶液褪色,不能与溴水加成褪色,说明该分子是烷烃,由于氢原子数较相同碳原子的链状烷烃少,说明该分子是环烷烃,可萃取溴水中的溴;PMR谱中也只有一个信号,说明该则分子高度对称,分子中的氢原子都是等效氢原子,则c的结构简式为 ![]() 。
。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】一个化学电池的总反应方程式为:Zn+Cu2+═Zn2++Cu,该化学电池的组成可能为( )
A | B | C | D | |
正极 | Cu | Cu | Zn | Al |
负极 | Zn | Zn | Cu | Zn |
电解质溶液 | H2SO4 | CuSO4 | ZnCl2 | Cu Cl2 |
A.A
B.B
C.C
D.D
【题目】在一定温度下,将气体X与气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
t∕min | 2 | 4 | 7 | 9 |
n(Y)∕mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前4min的平均反应速率υ(Z)=0.0125molL-1min-1
B.其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,达平衡时X的体积分数增大