题目内容
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
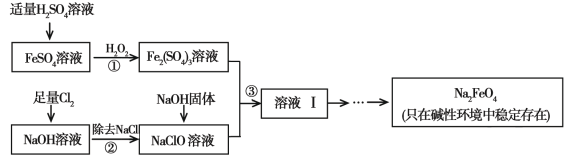
(1)高铁酸钠中铁元素的化合价为 ,次氯酸钠的电子式是________。
(2)步骤①反应的离子方程式是 。
(3)从溶液I中分离出Na2FeO4后,还有副产品Na2SO4 、NaCl,则步骤③中反应的离子方程式为 。
(4)工业上还可用电解浓NaOH溶液的方法制Na2FeO4,其工作原理如图所示:
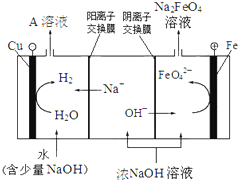
阳极的电极反应式为 。可循环使用的物质是 。
(5)计算Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的________倍,
【答案】(1)+6,![]() ;
;
(2)2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)Fe-6e-+8OH-=FeO42-+4H2O,NaOH溶液;(5)0.64。
【解析】
试题分析:(1)高铁酸钠中O显-2价,Na显+1价,化合价代数和为0,因此铁的价态是+6价,次氯酸钠属于离子化合物,其电子式为:![]() ;(2)利用过氧化氢的强氧化性,把Fe2+氧化成Fe3+,本身被还原成H2O,因此离子反应方程式为:2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O;(3)根据题目信息,NaClO把Fe2(SO4)3氧化成Na2FeSO4,本身被还原成NaCl,根据化合价的升降进行配平,其离子反应反应式为:2Fe3+ + 3ClO- + 10OH- = 2FeO42- + 3Cl- + 5H2O;(4)根据工作原理,阳极反应是Fe和OH-反应生成FeO42-,因此电极反应式为:Fe - 6e- + 8OH- =FeO42- + 4H2O,阴极反应式为2H2O+2e-=H2↑+2OH-,总电解反应式为Fe+2OH-+2H2O =FeO42-+3H2↑,阴极产生NaOH,因此NaOH循环使用;(5)FeO42-→Fe3+,单位质量得到电子是3/166=0.018,Cl2→Cl-,单位质量得到电子2/71=0.028,消毒效率为0.018/0.028=0.64。
;(2)利用过氧化氢的强氧化性,把Fe2+氧化成Fe3+,本身被还原成H2O,因此离子反应方程式为:2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O;(3)根据题目信息,NaClO把Fe2(SO4)3氧化成Na2FeSO4,本身被还原成NaCl,根据化合价的升降进行配平,其离子反应反应式为:2Fe3+ + 3ClO- + 10OH- = 2FeO42- + 3Cl- + 5H2O;(4)根据工作原理,阳极反应是Fe和OH-反应生成FeO42-,因此电极反应式为:Fe - 6e- + 8OH- =FeO42- + 4H2O,阴极反应式为2H2O+2e-=H2↑+2OH-,总电解反应式为Fe+2OH-+2H2O =FeO42-+3H2↑,阴极产生NaOH,因此NaOH循环使用;(5)FeO42-→Fe3+,单位质量得到电子是3/166=0.018,Cl2→Cl-,单位质量得到电子2/71=0.028,消毒效率为0.018/0.028=0.64。