题目内容
【题目】MnO2用途很广,它是一种广泛应用的氧化剂。例如将它加入熔态的玻璃中,可以除去带色的杂质(硫化物或亚铁盐),称为普通玻璃的“漂白剂”。在锰-锌干电池中用作去极剂,以氧化在电极上产生的氢。
(1)Zn- MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。其电解质溶液呈________性(填“酸”、“碱”或“中”),原因是_________________、________________(用离子方程式表示);该电池工作时,电子流向__________极(填“正”或 “负”)。
(2)工业上,常以菱锰矿(主要成分MnCO3,常含有少量铁、钙、锌等元素)为原料,用电解法可以制备MnO2。其制备过程如下:

写出酸浸的主要化学方程式:______________________。
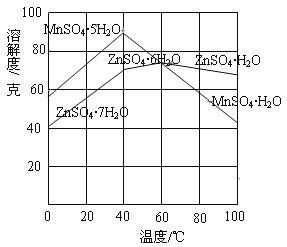
②下图可以看出,从MnSO4和ZnSO4混合溶液中结晶MnSO4·H2O晶体,需要控制的温度范围为______________(填字母)。
A.0~40℃ B.40~60℃ C.60℃以上
③请写出用惰性电极电解MnSO4溶液制备MnO2的阳极反应:___________________。
④该工艺产生的废水中含有较多的Mn2+,通常用H2S或者Na2S溶液处理。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
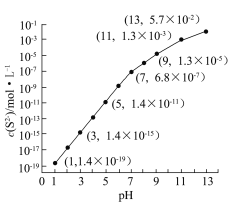
i.pH=13时,溶液中的c(H2S)+c(HS-)=__________mol·L-1;
ii.某溶液含x mol·L-1 Mn2+、0.10 mol·L-1 H2S,当调节溶液pH=5时,Mn2+开始沉淀,则x= 。[已知:Ksp(MnS)=2.8×10-13]
【答案】(1)酸,NH4++H2O![]() NH3﹒H2O+H+,
NH3﹒H2O+H+,
Zn2++2H2O![]() Zn(OH)2+2H+,正;
Zn(OH)2+2H+,正;
(2)①MnCO3+H2SO4===MnSO4+H2O+CO2↑;②C;
③Mn2+-2e-+2H2O===MnO2+4H+;④0.043,0.020。
【解析】
试题分析:(1)ZnCl2和NH4Cl都属于强酸弱碱盐,Zn2+和NH4+发生水解,Zn2++2H2O![]() Zn(OH)2+2H+、NH4++H2O
Zn(OH)2+2H+、NH4++H2O![]() NH3·H2O+H+,造成溶液中c(H+)>c(OH-),溶液显酸性,根据原电池的工作原理,电子从负极流向正极;(2)①菱锰矿成分是MnCO3,和硫酸反应:MnCO3+H2SO4=MnSO4+H2O+CO2↑;②根据溶解度和温度的关系,得到MnSO4·H2O,温度控制在60℃以上,因为随温度升高MnSO4·H2O的溶解度降低,析出MnSO4·H2O,故选项C正确;③阳极是失去电子,化合价升高,因此阳极反应式为Mn2++2H2O-2e-=MnO2+4H+;④根据物料守恒,c(S2-)+c(HS-)+c(H2S)=0.1,pH=13时,溶液中c(S2-)=5.7×10-2mol·L-1,因此c(HS-)+c(H2S)=0.043mol·L-1,根据溶度积的表示,Ksp=c(Mn2+)×c(S2-),pH=5时,c(S2-)=1.4×10-11mol·L-1,因此c(Mn2+)=0.020mol·L-1。
NH3·H2O+H+,造成溶液中c(H+)>c(OH-),溶液显酸性,根据原电池的工作原理,电子从负极流向正极;(2)①菱锰矿成分是MnCO3,和硫酸反应:MnCO3+H2SO4=MnSO4+H2O+CO2↑;②根据溶解度和温度的关系,得到MnSO4·H2O,温度控制在60℃以上,因为随温度升高MnSO4·H2O的溶解度降低,析出MnSO4·H2O,故选项C正确;③阳极是失去电子,化合价升高,因此阳极反应式为Mn2++2H2O-2e-=MnO2+4H+;④根据物料守恒,c(S2-)+c(HS-)+c(H2S)=0.1,pH=13时,溶液中c(S2-)=5.7×10-2mol·L-1,因此c(HS-)+c(H2S)=0.043mol·L-1,根据溶度积的表示,Ksp=c(Mn2+)×c(S2-),pH=5时,c(S2-)=1.4×10-11mol·L-1,因此c(Mn2+)=0.020mol·L-1。