题目内容
【题目】下列四支试管中分別盛有固体NaBr、NaCl、Na2SO3、Cu,分别向这四支试管中加入适量浓硫酸,部分现象如图所示:
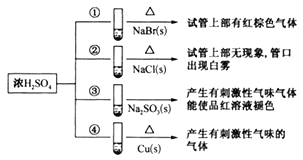
下列判断正确的是( )
A. 反应①和②的现象说明还原性:Br->Cl-
B. 浓硫酸与NaCl不反应,白雾是浓硫酸吸水所致
C. 反应③现象说明氧化性:浓硫酸>Na2SO3
D. 反应④的现象除产生刺激性气味的气体外,溶液中还析出蓝色晶体
【答案】A
【解析】A、有红棕色气体产生,此气体为Br2,浓硫酸作氧化剂,把Br-氧化成Br2,②中有白雾,此白雾是HCl的液滴,Cl-没有被氧化,说明Br-的氧化性强于Cl-,故A说法正确;B、浓硫酸与NaCl反应生成NaHSO4和HCl(g),白雾是HCl在空气中凝成的小液滴,故B错误;C、发生的Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,此反应不是氧化还原反应,故C错误;D、Cu与浓硫酸反应生成CuSO4、SO2、H2O,利用浓硫酸的吸水性,溶液种还析出白色固体,故D错误。

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目



