题目内容
【题目】磷尾矿难溶于水,主要含Ca5(PO4)3F和CaCO3·MgCO3。某研究小组提出了用磷尾矿制备CaCO3、Mg(OH)2、P4和CO的方案,其工艺流程图如下:
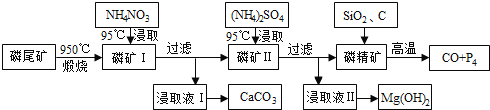
请回答下列问题:
(1)磷精矿[Ca5(PO4)3F]分解温度_______________(填“高于”、“低于” )950℃;
(2)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是________________,第一次浸取液用NH4NO3而不用的(NH4)2SO4原因是__________________________。
(3)磷精矿与SiO2、C发生反应时被还原的物质是_______________。
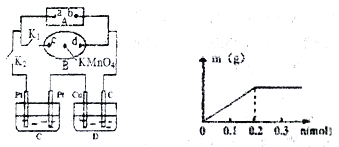
(4)其产物CO在工业上有重要的综合应用,现以CO、H2O、熔融Na2O组成的电池装置如图所示。
写出石墨Ⅰ电极上发生反应的电极反应式_______________,Na+向________(填写“石墨Ⅰ”或“石墨Ⅱ”)移动。
(5)CO也可由甲酸(HCOOH)制取,甲酸是易溶于水的一元弱酸。
①常温下关于1 L 0.1 mol·L-1 HCOONa溶液,下列关系不正确的是____________。
a.c(H+)·c(OH-)=1×10-14
b.c(H+)+c(HCOOH)=c(OH-)
c.c(Na+)=c(HCOOH)+c(HCOO-)
d.c(Na+)>c(H+)>c(HCOO-)>c(OH-)
②向1 L 0.1 mol·L-1 HCOONa溶液中加水稀释后,c(HCOOH)·c(OH-)的数值________(填写“增大”“减小”或“不变”)。
【答案】
(1)高于;
(2)NH4+水解使溶液呈酸性,H+能从磷矿I中浸取出Ca2+(或H+与CaO、Ca(OH)2反应生成Ca2+);CaSO4微溶于水,第一次若使用硫酸,不能完全浸取Ca2+
(3)Ca5(PO4)3F
(4)CO+O2-2e-=CO2;石墨Ⅱ;
(5)①d;②减小
【解析】
试题分析:磷尾矿[主要含Ca5(PO4)3F和CaCO3MgCO3]在950℃下煅烧,其中碳酸钙和碳酸镁分解,生成气体的成分为二氧化碳(CO2),磷矿Ⅰ的主要成分为Ca5(PO4)3F、CaO、MgO,NH4NO3溶液中铵离子水解呈酸性,可溶解CaO,得到的浸取液Ⅰ含有Ca2+,可生成CaCO3,磷矿Ⅱ含有Ca5(PO4)3F、MgO,加入硫酸铵浸取,浸取液Ⅱ含有镁离子,可生成氢氧化镁,磷精矿加入二氧化硅、C等,在高温下发生4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4。
2CaF2+30CO+18CaSiO3+3P4。
(1)根据流程图,在950℃煅烧是磷精矿[Ca5(PO4)3F]未分解,因此磷精矿的分解温度高于950℃,故答案为:高于;
(2)NH4+水解使溶液呈酸性,H+能从磷矿I中浸取出Ca2+;CaSO4微溶于水,第一次若使用硫酸,不能完全浸取Ca2+,因此第一次浸取液用NH4NO3而不用的(NH4)2SO4,故答案为:NH4+水解使溶液呈酸性,H+能从磷矿I中浸取出Ca2+;CaSO4微溶于水,第一次若使用硫酸,不能完全浸取Ca2+;
(3)根据流程图,磷精矿加入二氧化硅、C等,在高温下发生4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4,反应中P元素化合价降低,被还原,被还原的物质是Ca5(PO4)3F,故答案为:Ca5(PO4)3F;
2CaF2+30CO+18CaSiO3+3P4,反应中P元素化合价降低,被还原,被还原的物质是Ca5(PO4)3F,故答案为:Ca5(PO4)3F;
(4)石墨Ⅰ为负极,电极反应式为CO+O2-2e-=CO2;原电池中阳离子向正极移动,因此Na+向石墨Ⅱ移动,故答案为:CO+O2-2e-=CO2;石墨Ⅱ;
(5)①a.常温下,水的离子积常数c(H+)·c(OH-)=1×10-14,正确;b.根据质子守恒,有c(H+)+c(HCOOH)=c(OH-),正确;c.根据物料守恒有c(Na+)=c(HCOOH)+c(HCOO-),正确;d.HCOONa溶液水解显碱性,水解程度一般较小,c(Na+)>c(HCOO-) >c(H+)>c(OH-),错误;故选d;
②向1 L 0.1 mol·L-1 HCOONa溶液中加水稀释后,促进水解,c(HCOO-) 减小,温度不变,水解常数不变,K=![]() , c(HCOOH)·c(OH-)减小,故答案为:减小。
, c(HCOOH)·c(OH-)减小,故答案为:减小。