题目内容
7.室温下,等体积0.5mol/L的①KCl ②FeCl3 ③HF ④Na2CO3四种物质的水溶液中,所含阳离子数目由多到少的顺序是( )| A. | ④①②③ | B. | ③①②④ | C. | ①④③② | D. | ④②①③ |
分析 室温下,等体积、等浓度的这几种溶液中溶质的物质的量相等,K离子不水解、铁离子水解、HF是弱电解质部分电离、钠离子不水解,根据化学式知n(Na+)最大,铁离子水解但程度较小,据此分析解答.
解答 解:室温下,等体积、等浓度的这几种溶液中溶质的物质的量相等,K离子不水解、铁离子水解、HF是弱电解质部分电离、钠离子不水解,根据化学式知n(Na+)最大,铁离子水解但程度较小,HF电离程度较小,所以这几种溶液中阳离子物质的量大小顺序是n(Na+)>n(K+)>n(Fe3+)>n(H+),根据N=nNA知,物质的量越多其离子个数越多,所以阳离子数目大小顺序是N(Na+)>N(K+)>N(Fe3+)>N(H+),故选A.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查盐类水解、弱电解质的电离等知识点,明确盐特点及弱电解质电离特点即可解答,注意:强酸弱碱盐或强碱弱酸盐能水解但程度较小,题目难度不大.

练习册系列答案
相关题目
17.对于可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A. | 达到化学平衡时,4υ正(O2)=5υ逆(NO ) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 恒温、恒容时,当混合气体的密度不再变化时,表示反应达到了化学平衡状态 | |
| D. | 化学反应速率关系是:2υ正(NH3)=3υ正(H2O) |
18.使用下列能源会对环境造成污染的是( )
| A. | 风能 | B. | 石油 | C. | 氢能 | D. | 太阳能 |
15.下列物质易溶于水的是( )
| A. | 葡萄糖 | B. | 油脂 | C. | 苯 | D. | 乙烯 |
2.已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为( )
| A. | 4v(NH3)=5v(O2) | B. | 5v(O2)=6v(H2O) | C. | 4v(O2)=5v(NO) | D. | 2v(NH3)=3v(H2O) |
19.a、b、c、d、e、f、g为七种由短期周期元素构成的粒子,它们都有10个电子,其结构特点如下:
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可反应生成两个共价型g分子.
试写出:
(1)d分子的空间构型为三角锥形.
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:NaOH>Mg(OH)2 (用化学式表示).
(3)d溶于水的电离方程式NH3+H2O?NH3•H2O?NH4++OH-.
(4)g粒子所构成的晶体类型属分子晶体.
(5)c粒子是OH-,f粒子是H3O+(都用化学式表示).
| 粒子代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 单位电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
试写出:
(1)d分子的空间构型为三角锥形.
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:NaOH>Mg(OH)2 (用化学式表示).
(3)d溶于水的电离方程式NH3+H2O?NH3•H2O?NH4++OH-.
(4)g粒子所构成的晶体类型属分子晶体.
(5)c粒子是OH-,f粒子是H3O+(都用化学式表示).
16.下列离子方程式书写正确的是( )
| A. | 苯酚与碳酸钠反应:2C6H5OH+CO32-→2C6H5O-+CO2↑+H2O | |
| B. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| C. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O | |
| D. | SO2通入溴水中:SO2+2H2O+Br2═2H++SO42-+2HBr |
17.与CH2=CH2→CH2Br-CH2Br的变化属于同一反应类型的是( )
| A. | CH3COOH→CH3COOC2H5 | B. | C2H5Cl→CH2=CH2 | ||
| C. | 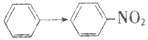 | D. | CH3CHO→C2H5OH |
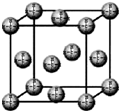 (1)2003年夏,全球化学家投票评选了化学史上十项最美的实验,1848年巴斯德用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首.请回答下列问题:
(1)2003年夏,全球化学家投票评选了化学史上十项最美的实验,1848年巴斯德用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首.请回答下列问题: .
.