题目内容
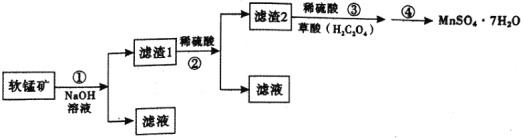
【题目】硫酸锰晶体(![]() )是重要的微量元素肥料之一。某兴趣小组在实验室中探究用软锰矿(主要成分为
)是重要的微量元素肥料之一。某兴趣小组在实验室中探究用软锰矿(主要成分为![]() ,含有少量
,含有少量![]() 、
、![]() 、
、![]() 等杂质制取硫酸锰晶体,其具体流程如下:
等杂质制取硫酸锰晶体,其具体流程如下:
已知:①反应原理为:![]() ;
;
②![]() 难溶于水。
难溶于水。
(1)滤渣2主要成分是![]() ,步骤②中的稀硫酸的作用是________。
,步骤②中的稀硫酸的作用是________。
(2)步骤③中采用![]() 硫酸和草酸晶体溶解
硫酸和草酸晶体溶解![]() ,草酸晶体的作用是________;配制
,草酸晶体的作用是________;配制![]() 硫酸时,需要的仪器除量筒、烧杯、玻璃棒外,还需要________。将滤渣2置于烧杯中,先加入稀硫酸,将溶液稍加热后,在搅拌下缓慢分批加入草酸晶体,直至烧杯中的固体全部溶解。在搅拌下缓慢分批加入草酸晶体的理由是________。
硫酸时,需要的仪器除量筒、烧杯、玻璃棒外,还需要________。将滤渣2置于烧杯中,先加入稀硫酸,将溶液稍加热后,在搅拌下缓慢分批加入草酸晶体,直至烧杯中的固体全部溶解。在搅拌下缓慢分批加入草酸晶体的理由是________。
(3)步骤④的具体实验操作有________,经洗涤后干燥得到![]() 晶体。
晶体。
(4)兴趣小组同学拟继续研究硫酸锰的高温分解的固体产物,经查资料可知:硫酸锰晶体高温下分解产物为![]() 、
、![]() 、
、![]() ,及水蒸气。为了确定
,及水蒸气。为了确定![]() 的化学式,采用下面装置进行测定(已知:
的化学式,采用下面装置进行测定(已知:![]() 的熔点为16.8℃,沸点为44.8℃)。
的熔点为16.8℃,沸点为44.8℃)。
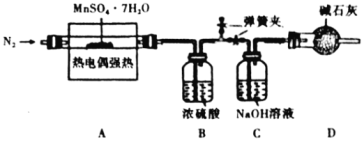
①![]() 装置中吸收的气体为________。
装置中吸收的气体为________。
②实验自始至终均需通入![]() ,其目的是________。
,其目的是________。
③若起始时,在装置A中加入![]() ,充分反应后,测得装置C增重6.4g,则
,充分反应后,测得装置C增重6.4g,则![]() 的化学式为________。
的化学式为________。
【答案】除去![]() 做还原剂,将MnO2还原为Mn2+ 100mL容量瓶、胶头滴管 防止MnO2固体表面产生MnC2O4而阻止反应进行,并防止草酸过量引入杂质 加热浓缩、冷却结晶、过滤 SO2 排出装置中的空气,并将生成的气体全部赶至后面装置吸收 Mn3O4
做还原剂,将MnO2还原为Mn2+ 100mL容量瓶、胶头滴管 防止MnO2固体表面产生MnC2O4而阻止反应进行,并防止草酸过量引入杂质 加热浓缩、冷却结晶、过滤 SO2 排出装置中的空气,并将生成的气体全部赶至后面装置吸收 Mn3O4
【解析】
由题给流程可知,向软锰矿中加入氢氧化钠溶液,酸性氧化物二氧化硅和两性氧化物氧化铝溶于氢氧化钠溶液生成硅酸钠和偏铝酸钠,二氧化锰和氧化铁不溶解,则滤渣1为二氧化锰和氧化铁;向滤渣1中加入稀硫酸,碱性氧化物氧化铁溶于稀硫酸生成硫酸铁,二氧化锰不溶解,则滤渣2为二氧化锰;向滤渣2加入稀硫酸和草酸晶体,酸性条件下二氧化锰和草酸发生氧化还原反应生成硫酸锰,硫酸锰溶液经加热浓缩、冷却结晶、过滤、洗涤、干燥得到MnSO4·7H2O晶体。
(1)步骤②为向滤渣1中加入稀硫酸,碱性氧化物氧化铁溶于稀硫酸生成硫酸铁,二氧化锰不溶解,则稀硫酸的作用是溶解除去Fe2O3,故答案为:除去Fe2O3;
(2)步骤③为向滤渣2加入6.0mol/L硫酸和草酸晶体,酸性条件下二氧化锰和草酸发生氧化还原反应生成,反应中二氧化锰做氧化剂,草酸做还原剂,将MnO2还原为Mn2+;配制100mL6.0mol/L硫酸时用到的仪器有量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管;由题意可知MnC2O4难溶于水,溶解二氧化锰过程中,为防止MnO2固体表面产生MnC2O4而阻止反应进行和草酸过量引入新杂质,应先加入稀硫酸,将溶液稍加热后,在搅拌下缓慢分批加入草酸晶体,直至烧杯中的固体全部溶解,故答案为:做还原剂,将MnO2还原为Mn2+;100mL容量瓶、胶头滴管;防止MnO2固体表面产生MnC2O4而阻止反应进行,并防止草酸过量引入杂质;
(3)步骤④为硫酸锰溶液经加热浓缩、冷却结晶、过滤、洗涤、干燥得到MnSO4·7H2O晶体,故答案为:加热浓缩、冷却结晶、过滤;
①由题意可知,MnSO4·7H2O晶体受热分解生成的气体中含有二氧化硫、三氧化硫和水蒸气,三氧化硫能溶于浓硫酸,二氧化硫不溶于浓硫酸,混合气体经过浓硫酸,浓硫酸吸收了三氧化硫和水蒸气,则氢氧化钠溶液吸收的气体为二氧化硫,故答案为:SO2;
②实验开始时,通入氮气的目的是排出装置中的空气,实验中通入氮气的目的是将MnSO4·7H2O晶体受热分解生成的气体全部赶至后面装置吸收,防止影响实验结果,故答案为:排出装置中的空气,并将生成的气体全部赶至后面装置吸收;
③83.1gMnSO4·7H2O的物质的量为![]() =0.3mol,6.4g二氧化硫的物质的量为
=0.3mol,6.4g二氧化硫的物质的量为![]() =0.1mol,设MnxOy中锰元素的化合价为a,由得失电子数目守恒可得0.3mol×(a—2)=0.1mol×2,解得a=
=0.1mol,设MnxOy中锰元素的化合价为a,由得失电子数目守恒可得0.3mol×(a—2)=0.1mol×2,解得a=![]() ,则MnxOy为Mn3O4,故答案为:Mn3O4。
,则MnxOy为Mn3O4,故答案为:Mn3O4。

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案【题目】下表是元素周期表中的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | E | F | H | J | ||||
3 | B | C | D | G | I |
根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是________,氧化性最强的单质是________,还原性最强的单质是________。
(2)最高价氧化物对应的水化物中,碱性最强的是________,酸性最强的是________,呈两性的是________。
(3)A分别与E、F、G、H、I形成的简单气态化合物中,最稳定的是________。
(4)在B、C、D、G、I中,原子半径最大的是________。
(5)元素C与I形成的化合物的电子式是________。
【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
Ⅰ | 0.5molI2、0.5molH2 | w(HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
Ⅱ | xmolHI | w(HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=kaw(H2)w(I2),v逆=kbw2(HI),其中ka、kb为常数。下列说法不正确的是( )
A. 温度为T时,该反应![]() =64
=64
B. 容器I中在前20min的平均速率v(HI)=0.025molL-1min-1
C. 若起始时,向容器I中加入物质的量均为0.1mol的H2、I2、HI,反应逆向进行
. 无论x为何值,两容器中达平衡时w(HI)%均相同