题目内容
【题目】I.(1) SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2(s)和H2O(l)。已知室温下2 g SiH4自燃放出的热量为89.2 kJ,则其热化学方程式为: _____________________。
(2)沼气是一种能源,它的主要成分是CH4,其燃烧的热化学方程式为:CH4(g)+2O2(g) = CO2(g)+2H2O(l ) ΔH=-890 kJ/mol,又已知H2O(l)=H2O(g) ΔH=+44 kJ/mol,则11.2 L(标准状况)CH4完全燃烧生成气态水时放出的热量为_______________。
Ⅱ.已知下列几种烷烃的燃烧热如下:
烷烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | 己烷 |
燃烧热/ (kJ·mol-1) | 890.3 | 1559.8 | 2219.9 | 2877.0 | 3536.2 | 4163.1 |
今有10 L(标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480 kJ。
(1)试写出乙烷气体燃烧的热化学方程式___________________________________。
(2)计算该天然气中甲烷的体积分数____________(保留小数点后两位)。
(3)由上表可总结出的近似规律是______________________________________________。
(4)根据(3)的近似规律可预测癸烷的燃烧热约为______kJ·mol-1。
【答案】SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H= -1427.2kJ/mol 401kJ 2C2H6(g)+7O2(g) = 4CO2(g)+6H2O(l) △H= -3119.6 kJ/mol 72.38% 烷烃分子中每增加一个CH2原子团,燃烧热平均增加654kJ/mol左右 6779 kJ·mol-1
【解析】
I.(1) 2 g SiH4为0.0625mol,自燃放出的热量为89.2 kJ,则1 mol放出的热量为![]() =1427.2 kJ,热化学方程式为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H= -1427.2kJ/mol;
=1427.2 kJ,热化学方程式为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H= -1427.2kJ/mol;
答案为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H= -1427.2kJ/mol;
(2)①CH4(g)+2O2(g) = CO2(g)+2H2O(l) ΔH=-890 kJ/mol,②H2O(l)==H2O(g) ΔH=+44 kJ/mol,由盖斯定律:①+②×2得:CH4(g)+2O2(g) = CO2(g)+2H2O(g) ΔH=-802 kJ/mol,1mol完全燃烧生成气态水时放出的热量802 kJ,则11.2 L(标准状况)CH4为0.5 mol完全燃烧生成气态水时放出的热量为401kJ;
答案为:401kJ;
Ⅱ(1)由表中燃烧热数值可知,1mol乙烷燃烧生成二氧化碳与液态水,放出的热量为1559.8kJ,乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g) = 4CO2(g)+6H2O(l) △H= -3119.6 kJ/mol;
故答案为:2C2H6(g)+7O2(g) = 4CO2(g)+6H2O(l) △H= -3119.6 kJ/mol
(2)10L(在标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480kJ,平均燃烧热为 =1075.2kJ/mol,根据十字交叉法计算甲烷与乙烷的体积比:
=1075.2kJ/mol,根据十字交叉法计算甲烷与乙烷的体积比: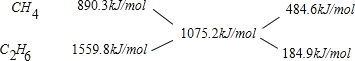
所以甲烷与乙烷的体积比为484.6:184.9,甲烷的体积分数为![]() ×100%=72.38%
×100%=72.38%
故答案为:72.38%。
(3)根据表中数据可知,碳原子数目相邻的烷烃的燃烧热之差,基本为定值,即烷烃分子中每增加一个CH2燃烧热平均增加基本为定值。
乙烷与甲烷燃烧热相差:1559.8kJ/mol-890.3kJ/mol=669.5kJ/mol,
丙烷与乙烷燃烧热相差:2219.9kJ/mol-1559.8kJ/mol=660.1kJ/mol,
丁烷与丙烷燃烧热相差:2877.0kJ/mol-2219.9kJ/mol=657.1kJ/mol,
戊烷与丁烷燃烧热相差:3536.2kJ/mol-2877.0kJ/mol=659.2kJ/mol,
己烷与戊烷燃烧热相差:4163.1kJ/mol-3536.2kJ/mol=626.9kJ/mol,
![]() =654kJ/mol,
=654kJ/mol,
烷烃分子中每增加一个CH2燃烧热平均增加654kJ/mol左右,
故答案为:烷烃分子中每增加一个CH2,,燃烧热平均增加654kJ/mol左右;
(4)根据(3)的近似规律可预测癸烷与己烷相差4个CH2,燃烧热约为4163.1kJ/mol+654kJ/mol×4=6779 kJ/mol
答案为:6779 kJ/mol

【题目】以含镍废硫酸盐(含 Ni2+ 、Fe2+ 、Cu2+ 、Co2+ 、A13+ 、Mn2+ 、Cr3+ 、Mg2+ 、Zn2+ 等)为原料制取NiSO4·6H2O 的工艺流程如下:
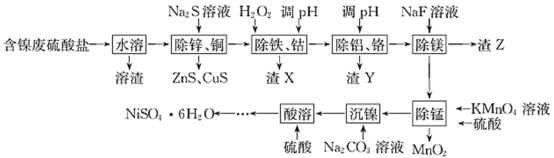
相关金属离子形成氢氧化物沉淀的pH 范围如下:
金属离子 | Co2+ | Co3+ | Fe2+ | Fe3+ | A13+ | Cr3+ | Ni2+ |
开始沉淀的pH | 7.2 | 0.23 | 6.3 | 1.5 | 4.1 | 4.3 | 6.9 |
沉淀完全的pH | 9.2 | 1.1 | 8.3 | 2.8 | 5.4 | 5.6 | 8.9 |
回答下列问题:
(1)已知1gKsp(CuS)= -47.6,1gKsp(ZnS)= -23.8,则反应ZnS+Cu2+![]() CuS+Zn2+的平衡常数对数值1gK= ________________________。
CuS+Zn2+的平衡常数对数值1gK= ________________________。
(2)“除铁、钴”时,加入H2O2的目的是 ______________,得到的渣X为________。
(3) “除铝、铬”时,调pH 范围为 _________;滤渣Y 中含Cr(OH)3,其性质与 A1(OH)3 类似,写出Cr(OH)3与NaOH反应的化学方程式: __________________。
(4)“除锰”时,发生反应的离子方程式为___________________________。
(5)“酸溶”得到溶液制备 NiSO4·6H2O晶体,还需进行的操作工艺是___________。