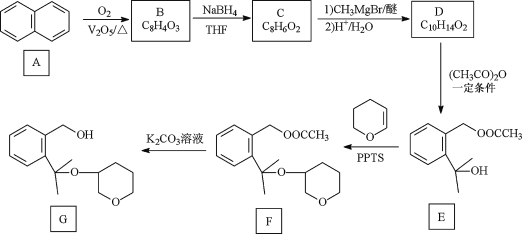
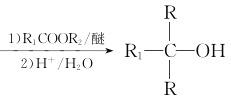
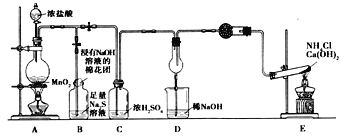
题目内容
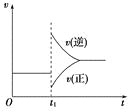
【题目】某温度下,相同pH的盐酸和醋酸分别加水稀释至平衡,pH随溶液体积变化的曲线如下图所 示。据图判断正确的是
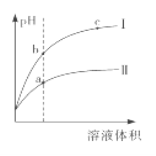
A. Ⅱ为盐酸稀释时的pH变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
【答案】B
【解析】
醋酸是弱酸,不完全电离使溶液显酸性,溶液浓度越低,电离程度越大;盐酸是强酸,在水溶液中完全电离,加等量的水稀释,盐酸溶液的pH变化大于醋酸溶液的pH变化,因此Ⅰ为盐酸的pH变化曲线,Ⅱ为醋酸的pH变化曲线。
A项,由分析可知,Ⅰ为盐酸的pH变化曲线,Ⅱ为醋酸的pH变化曲线,故A项错误;
B项,b、c两点在盐酸的pH变化曲线上,c点pH较大,稀释倍数较高,溶液中离子浓度低于b点溶液中离子浓度,离子浓度越大,导电性越强,故B项正确;
C项,KW只和温度有关,温度不变,KW不变,故C项错误;
D项,相同体积和pH的盐酸与醋酸溶液,醋酸溶液浓度大,稀释相同倍数之后,由于醋酸是弱酸,因此浓度依旧大于盐酸溶液的浓度,因此a点酸的总浓度大于b点酸的总浓度,故D项错误。
综上所述,本题正确答案为B。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】I.(1) SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2(s)和H2O(l)。已知室温下2 g SiH4自燃放出的热量为89.2 kJ,则其热化学方程式为: _____________________。
(2)沼气是一种能源,它的主要成分是CH4,其燃烧的热化学方程式为:CH4(g)+2O2(g) = CO2(g)+2H2O(l ) ΔH=-890 kJ/mol,又已知H2O(l)=H2O(g) ΔH=+44 kJ/mol,则11.2 L(标准状况)CH4完全燃烧生成气态水时放出的热量为_______________。
Ⅱ.已知下列几种烷烃的燃烧热如下:
烷烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | 己烷 |
燃烧热/ (kJ·mol-1) | 890.3 | 1559.8 | 2219.9 | 2877.0 | 3536.2 | 4163.1 |
今有10 L(标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480 kJ。
(1)试写出乙烷气体燃烧的热化学方程式___________________________________。
(2)计算该天然气中甲烷的体积分数____________(保留小数点后两位)。
(3)由上表可总结出的近似规律是______________________________________________。
(4)根据(3)的近似规律可预测癸烷的燃烧热约为______kJ·mol-1。