题目内容
【题目】锂空气电池是一种新型的二次电池,其放电时的工作原理如图所示。下列说法正确的是( )
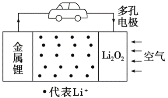
A.电解液中,Li+由多孔电极迁移向锂电极
B.该电池放电时,负极发生了还原反应
C.充电时,电池正极的反应式为Li2O2-2e-=2Li++O2↑
D.电池中的电解液可以是有机电解液或稀盐酸等
【答案】C
【解析】
A. 锂电极作负极,多孔电极作正极,电解液中,阳离子移向阴极,所以Li+由锂电极迁移向多孔电极,故A错误;
B. 该电池放电时,负极发生了氧化反应,故B错误;
C. 正极上是氧气得电子生成氢氧根离子,则电极方程式为O2+4e-+2H2O=4OH-,故C错误;
D. 金属锂能与盐酸反应生成氢气,所以电池中的有机电解液不可以用稀盐酸代替,故D错误;

【题目】蛇纹石矿可以看做是由MgO、![]() 、
、![]() 、
、![]() 组成.由蛇纹石制取碱式碳酸镁的实验步骤如下:
组成.由蛇纹石制取碱式碳酸镁的实验步骤如下:

氢氧化物 |
|
|
|
开始沉淀pH |
|
|
|
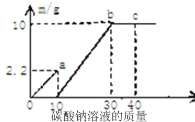
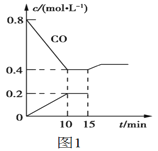
(1)蛇纹石矿加盐酸溶解后,溶液里除了![]() 外,还含有的金属离子是 ______
外,还含有的金属离子是 ______
(2)进行Ⅰ操作时,控制溶液![]() 有关氢氧化物沉淀的pH见上表
有关氢氧化物沉淀的pH见上表![]() 不能过量,若
不能过量,若![]() 过量可能会导致 ______ 溶解、 ______ 沉淀生成.
过量可能会导致 ______ 溶解、 ______ 沉淀生成.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入 ______ ![]() 填入物质的化学式
填入物质的化学式![]() ,然后 ______
,然后 ______ ![]() 依次填写实验操作名称
依次填写实验操作名称![]() .
.
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是 ______ ![]() 填写物质化学式
填写物质化学式![]() .
.
(5)若热分解不完全,所得碱式碳酸镁中将混有![]() ,则产品中镁的质量分数 ______
,则产品中镁的质量分数 ______ ![]() 填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量大于
填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量大于![]() .
.
【题目】下列转化及解释均正确的是( )
转化 | 解释 | |
A | CuS+H2SO4=CuSO4+H2S↑ | 酸性:H2SO4>H2S |
B | AgCl(s)+I-(aq)AgI(s)+Cl-(aq) | Kap(AgCl)<Kap(AgI) |
C | 2Fe+3Cl2 | 氧化性:Cl2>S |
D | C(s,石墨)=C(s,金刚石) △H=+1.9kJ/mol | 稳定性:石墨 |
A.AB.BC.CD.D