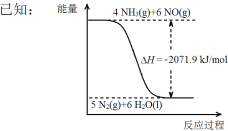
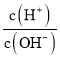题目内容
【题目】可以利用NO2的平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程。

①按图所示将实验装置连接好。
②向甲烧杯的水中投入一定量的CaO固体,此烧杯中的NO2平衡混合气体的红棕色变深;向乙烧杯中加入NH4NO3晶体,此时烧杯中NO2平衡混合气体颜色变浅。
回答下列问题:
(1)CaO与水反应的化学方程式为_______________________,该反应为________(填“吸热反应”或“放热反应”),CaO与H2O的总能量________(填“高于”或“低于”)Ca(OH)2的能量。
(2)NH4NO3晶体溶于水后,水的温度________(填“升高”或“降低”)。NH4NO3溶于水________(填“是”或“不是”)吸热反应。
(3)查阅资料知,NO2的平衡气体中存在的可逆反应为2NO2(g)![]() N2O4(g),已知NO2为红棕色,N2O4为无色,结合实验知,当温度升高时,原平衡________(填“未被破坏”或“发生移动”),此时反应速率________(填“增大”“减小”或“无变化”)。混合气体的颜色不再改变________(填“能”或“不能”)证明反应已达平衡。
N2O4(g),已知NO2为红棕色,N2O4为无色,结合实验知,当温度升高时,原平衡________(填“未被破坏”或“发生移动”),此时反应速率________(填“增大”“减小”或“无变化”)。混合气体的颜色不再改变________(填“能”或“不能”)证明反应已达平衡。
【答案】CaO+H2O===Ca(OH)2放热反应高于降低不是发生移动增大能
【解析】
(1)CaO与水反应生成氢氧化钙,该反应是放热反应;(2)硝酸铵溶解于水后吸热,所以会使溶液温度明显降低,是物理变化所以不是吸热反应;(3)2NO2(g)![]() N2O4(g)正反应是放热反应,所以升高温度逆向移动,正逆反应速率都加快,混合气体的颜色不变说明二氧化氮的浓度不变,化学反应达平衡状态。
N2O4(g)正反应是放热反应,所以升高温度逆向移动,正逆反应速率都加快,混合气体的颜色不变说明二氧化氮的浓度不变,化学反应达平衡状态。
(1)CaO与水反应生成氢氧化钙,反应方程式为CaO+H2O═Ca(OH)2,该反应为放热反应;
(2)硝酸铵溶解于水后吸热,所以会使溶液温度明显降低,溶解过程是物理变化所以不是吸热反应;(3)2NO2(g)![]() N2O4(g)正反应是放热反应,所以升高温度逆向移动,正逆反应速率都加快,混合气体的颜色不变说明二氧化氮的浓度不变,化学反应达平衡状态。
N2O4(g)正反应是放热反应,所以升高温度逆向移动,正逆反应速率都加快,混合气体的颜色不变说明二氧化氮的浓度不变,化学反应达平衡状态。

【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】![]() __________
__________
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
|
|
|
稀硫酸 | ||
1 | 3.0 | 2.0 | 1.0 | 2.0 | 4.0 |
2 | 2.0 | 3.0 | 1.0 | 2.0 | 5.2 |
3 | 1.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
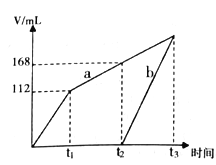
(1)根据上表中的实验数据,可以得到的结论是___________。
(2)利用实验1中数据计算,用![]() 的浓度变化表示的平均反应速率为:
的浓度变化表示的平均反应速率为: ![]() _____________
_____________
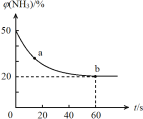
(3)该小组同学根据经验绘制了![]() 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中
随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中![]() 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
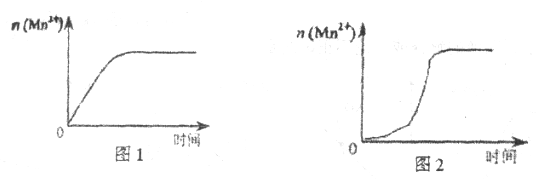
①该小组同学提出的假设是____________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
|
|
|
稀硫酸 | |||
4 | 3.0 | 2.0 | 1.0 | 2.0 | ____ | t |
③若该小组同学提出的假设成立,应观察到的现象是______________。