题目内容
【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g),温度为T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w (HI)与反应时间t的关系如下表:
2HI(g),温度为T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w (HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
I | 0.5 mol I2、0.5 mol H2 | w (HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
II | x mol HI | w (HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=ka·w(H2)·w(I2),v逆=kb·w2(HI),其中ka、kb为常数。下列说法正确的是:
A. 温度为T时,该反应![]() = 64
= 64
B. 容器I中在前20 min的平均速率v(HI)=0.0125 mol·L-1·min-1
C. 若起始时向容器I中加入物质的量均为0.1 mol的H2、I2、HI,反应逆向进行
D. 若两容器中存在kaⅠ=kaⅡ且kbⅠ=kbⅡ,则x的值一定为1
【答案】AD
【解析】H2(g)+I2(g)![]() 2HI(g)
2HI(g)
起始浓度(mol/L) 0.5 0.5 0
变化浓度(mol/L) n n 2n
平衡浓度(mol/L) 0.5-n 0.5-n 2n
w(HI)/%=![]() ,n=0.4,平衡常数 K=
,n=0.4,平衡常数 K=![]() 。A.反应达到平衡状态时正逆反应速率相等,kaw(H2)w(I2)=v正=v逆=kbw2(HI),则ka/kb=w2(HI)/w(H2)·w(I2)=K=64,A正确;B.容器I中前20 min内
。A.反应达到平衡状态时正逆反应速率相等,kaw(H2)w(I2)=v正=v逆=kbw2(HI),则ka/kb=w2(HI)/w(H2)·w(I2)=K=64,A正确;B.容器I中前20 min内
H2(g)+I2(g)![]() 2HI(g)
2HI(g)
起始浓度(mol/L) 0.5 0.5 0
变化浓度(mol/L) m m 2m
平衡浓度(mol/L) 0.5-m 0.5-m 2m
w(HI)%=![]() ,m=0.25mol,容器I中前20 min的平均速率,v(HI)=0.25mol/L÷20min=0.0125molL-1min-1,B正确;C.若起始时,向容器I中加入物质的量均为0.l mol的H2、I2、HI,此时浓度商Qc=
,m=0.25mol,容器I中前20 min的平均速率,v(HI)=0.25mol/L÷20min=0.0125molL-1min-1,B正确;C.若起始时,向容器I中加入物质的量均为0.l mol的H2、I2、HI,此时浓度商Qc=![]() <K=64,反应正向进行,C错误;D.若两容器中,kaⅠ=kaⅡ且kbⅠ=kbⅡ,达到平衡状态相同,w(HI)/%为80%,则
<K=64,反应正向进行,C错误;D.若两容器中,kaⅠ=kaⅡ且kbⅠ=kbⅡ,达到平衡状态相同,w(HI)/%为80%,则
H2(g)+I2(g)![]() 2HI(g)
2HI(g)
起始浓度(mol/L) 0.5 0.5 0
0 0 1
则x的值一定为1,D正确;答案选AD。

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】对于数以千万计的化学物质和如此丰富的化学变化,分类法的作用几乎是无可替代的。如:纯净物根据其组成和性质可进行如下分类。
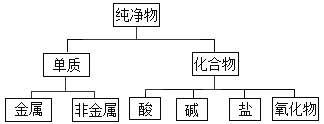
(1)如图所示的分类方法属于_______________。
(2)某化学兴趣小组对下列四组物质进行研究:
A.HCl、H2SO4、H2CO3、HNO3
B.Na2CO3、NaNO3、AgNO3、Ba(NO3)2
C.FeCl3溶液、蒸馏水、CaCO3悬浊液、Fe(OH)3胶体
D.NaOH、KOH、Ba(OH)2、Fe2O3
①填写下列空白:
A组 | B组 | C组 | D组 | |
分类标准 | 含氧酸 | ________ | 分散系 | ________ |
不属于该类别的物质 | ________ | Na2CO3 | ________ | Fe2O3 |
②写出①表中发生反应的化学方程式:
A+ B→气体__________________________;A+D__________________________。


