题目内容
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
部分含钒物质在水中的溶解性如下:
回答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热法,该反应的化学方程式为_______
(2)为了提高钒的浸出率,用酸浸使催化剂中的V2O5转变成可溶于水的VOSO4,与水浸液合并,再用KClO3氧化,使+4价的V氧化成易溶于水的(VO2)2SO4。反应①的离子方程式为_______;反应②的离子方程式为ClO3-+6VO2++3H2O=6VO2++6H++Cl-。
(3)该工艺中反应③的沉淀率是回收钒的关键之一,该步反应的离子方程式为_______。
(4) 实验室用的原料中V2O5占6%(原料中的所有钒已换算成V2O5)。取100g该废钒催化剂按工业生产的步骤进行实验,当加入100 mL 0.1 mol·L-1的KC1O3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是_______ (已知V2O5的相对分子质量为182)。
(5) 全钒液储能电池是利用不同价态的离子对之间的氧化还原反应来实现化学能和电能相互转化的装置,其原理如右下图所示。已知电池的总反应式为VO2++V2++2H+ VO2++V3++H2O
VO2++V3++H2O
①放电时的正极反应式为______________。
②放电过程中氢离子的作用是______________,充电时若转移的电子为2mol,则左槽溶液中n(H+)的变化量为______________。
(16分)(1)3V2O5+10Al 6V+5Al2O3 (2分) (2)①V2O5+SO32-+4H+=2VO2++SO42-+2H2O(3分)
6V+5Al2O3 (2分) (2)①V2O5+SO32-+4H+=2VO2++SO42-+2H2O(3分)
(3)NH4++VO3-=NH4VO3↓(2分) (4)91%(3分) (5)①VO2++2H++e-=VO2++H2O(2分)
②参与正极反应和通过交换膜定向移动使电流通过溶液(2分); 2mol(2分)
解析试题分析:(1)铝是活泼的金属,能和五氧化二钒发生铝热反应生成单质矾和氧化铝,反应的化学方程式为3V2O5+10Al 6V+5Al2O3。
6V+5Al2O3。
(2)根据溶解性表知,滤渣是V2O5,酸性条件下,V2O5和亚硫酸钠发生氧化还原反应生成VOSO4,反应的离子反应方程式为V2O5+SO32-+4H+=2VO2++SO42-+2H2O。
(3)反应③是复分解反应,反应的离子方程式是NH4++VO3-=NH4VO3↓。
(4)根据V2O5+SO32-+4H+=2VO2++SO42-+2H2O、ClO3-+6VO2++3H2O=6VO2++6H++Cl-可知:
3V2O5~6VO2+~ClO3-
3mol 1mol
n 0.01mol
所以n=0.03mol
因此该实验中钒的回收率是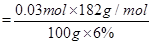 ×100%=91.0%
×100%=91.0%
(5)①原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应。根据总的方程式可知VO2+得到电子被还原为VO2+,因此正极电极反应式是VO2++2H++e-=VO2++H2O。
②根据①可知,放电时正极消耗氢离子,所以放电过程中氢离子的作用是参与正极反应和通过交换膜定向移动使电流通过溶液。根据装置图可知,充电时左槽电极和电源的正极相连,做阳极,电极反应式是VO2++H2O-e-=VO2++2H+,所以充电时若转移的电子为2mol,则左槽溶液中n(H+)的变化量为2mol。
考点:考查铝热反应;氧化还原反应方程式的书写和计算;原电池和电解池原理的有关应用和计算


 2MgCl2(aq) +SiO2 (s) + 2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq) +SiO2 (s) + 2H2O(l) △H =-49.04 kJ·mol-1
