题目内容
(1)向Na2CO3的浓溶液中逐滴加入稀盐酸,直到不再生成CO2气体为止,则在此过程中,溶液的c(HCO)变化趋势可能是:①逐渐减小;②逐渐增大;③先逐渐增大,而后减小;④先逐渐减小,而后增大。4种趋势中可能的是________。
(2) pH相同的HCl溶液、H2SO4溶液、CH3COOH溶液各100 mL。
①3种溶液中,物质的量浓度最大的是________。
②分别用0.1 mol/L的NaOH溶液中和,其中消耗NaOH溶液最多的是________。
③与等量的锌粉反应,反应开始时,反应速率________。
A.HCl最快 B.H2SO4最快 C.CH3COOH最快 D.一样快
(3)某温度下,纯水中c(H+)=2×10-7mol/L,则此时c(OH-)=________mol/L。相同条件下,测得:①NaHCO3溶液,②CH3COONa溶液,③NaClO溶液,3种溶液的pH相同,那么,它们的物质的量浓度由小到大的顺序是 。
(4)已知:酸性H2CO3>HClO>HCO,判断在等浓度的NaClO、NaHCO3混合液中,各种离子浓度关系正确的是________
A.c(Na+)>c(HCO)>c(H+)>c(OH-)
B.c(HCO)>c(ClO-)>c(OH-)
C.c(HClO)+c(ClO-)=c(HCO)+c(CO)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO)+c(ClO-)+c(OH-)+c(CO)
(2) pH相同的HCl溶液、H2SO4溶液、CH3COOH溶液各100 mL。
①3种溶液中,物质的量浓度最大的是________。
②分别用0.1 mol/L的NaOH溶液中和,其中消耗NaOH溶液最多的是________。
③与等量的锌粉反应,反应开始时,反应速率________。
A.HCl最快 B.H2SO4最快 C.CH3COOH最快 D.一样快
(3)某温度下,纯水中c(H+)=2×10-7mol/L,则此时c(OH-)=________mol/L。相同条件下,测得:①NaHCO3溶液,②CH3COONa溶液,③NaClO溶液,3种溶液的pH相同,那么,它们的物质的量浓度由小到大的顺序是 。
(4)已知:酸性H2CO3>HClO>HCO,判断在等浓度的NaClO、NaHCO3混合液中,各种离子浓度关系正确的是________
A.c(Na+)>c(HCO)>c(H+)>c(OH-)
B.c(HCO)>c(ClO-)>c(OH-)
C.c(HClO)+c(ClO-)=c(HCO)+c(CO)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO)+c(ClO-)+c(OH-)+c(CO)
(1) ③
(2) ①CH3COOH ②CH3COOH ③D
(3) 2×10-7 NaClO<NaHCO3<CH3COONa
(4) C
(2) ①CH3COOH ②CH3COOH ③D
(3) 2×10-7 NaClO<NaHCO3<CH3COONa
(4) C
(1)碳酸钠和盐酸反应生成碳酸氢钠和氯化钠,当盐酸过量时,碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,所以溶液中碳酸氢根离子浓度的变化是:先增大后减小,故选③;
(2)①一元酸中,强酸的浓度和氢离子浓度相等,弱酸中酸的浓度大于氢离子浓度;二元酸中,氢离子浓度为强酸浓度的2倍,所以pH相同的HCl溶液、H2SO4溶液、CH3COOH溶液中物质的量浓度最大的是醋酸,故答案为:醋酸;
②pH相同的HCl溶液、H2SO4溶液、CH3COOH溶液中,醋酸是弱电解质,所以醋酸的浓度最大,中和相同体积、相同pH值的三种酸,醋酸需要的氢氧化钠最多,
故答案为:CH3COOH;
⑶纯水中c(OH-)=c(H+)=2×10-7mol/L,酸性:CH3COOH> H2CO3> HClO,对应水解,由弱到强,3种溶液的pH相同,那么,它们的物质的量浓度由小到大的顺序是NaClO<NaHCO3<CH3COONa;
⑷A、不正确,溶液应呈碱性;B、不正确,ClO―水解能力弱,c(ClO-)>c(HCO)> c(OH-);C、正确;是物料守恒;D、不正确,电荷守恒应为c(Na+)+c(H+)=c(HCO)+c(ClO-)+c(OH-)+2c(CO)。

练习册系列答案
相关题目
 H++B(OH)4-,该反应中的碱是 (填H3BO3或H2O);
H++B(OH)4-,该反应中的碱是 (填H3BO3或H2O); )=c(A-)时,a一定等于20
)=c(A-)时,a一定等于20 ,则相同条件时,酸性
,则相同条件时,酸性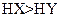
 ,则相同条件时,酸性
,则相同条件时,酸性
 ,则相同条件时,酸性HX<HY
,则相同条件时,酸性HX<HY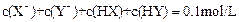 ,则一定有
,则一定有