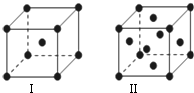
题目内容
10.黄铁矿的主要成分是FeS2,FeS2读作“过硫化亚铁”,它是离子化合物,其中有类似于Na2O2结构,则下列说法中正确的是( )| A. | 与盐酸反应的化学方程式为:FeS2+2HCl═FeCl2+S↓+H2S↑ | |
| B. | 在FeS2中,硫元素的化合价与辉铜矿(主要成分是Cu2S)中硫元素的化合价相同 | |
| C. | FeS2中的Fe元素位于第4周期第ⅧB族 | |
| D. | 若FeS2在空气中燃烧时生成Fe2O3和SO2,则1mol FeS2在反应中将失去6mol e- |
分析 A、FeS2中硫元素化合价-1价,在酸溶液中发生自身氧化还原反应,和盐酸反应生成氯化亚铁、硫单质和硫化氢;
B、在FeS2中,硫元素的化合价为-1价,辉铜矿主要成分是Cu2S,硫元素化合价-2价;
C、铁为26号元素,位于第四周期第Ⅷ族;
D、依据FeS2在空气中燃烧时生成Fe2O3和SO2,反应中元素化合价变化结合反应的定量关系计算电子转移.
解答 解:A、FeS2中硫元素化合价-1价,在酸溶液中发生自身氧化还原反应,和盐酸反应生成氯化亚铁、硫单质和硫化氢,反应的化学方程式为:FeS2+2HCl═FeCl2+S↓+H2S↑,故A正确;
B、在FeS2中,硫元素的化合价为-1价,辉铜矿主要成分是Cu2S,硫元素化合价-2价,元素的化合价相同不同,故B错误;
C、铁为26号元素,有四个电子层,最外层电子为2个电子,位于第四周期第Ⅷ族,故C错误;
D、依据FeS2在空气中燃烧时生成Fe2O3和SO2,反应中元素化合价变化结合反应的定量关系计算电子转移,4FeS2+11O2=8SO2+2Fe2O3,4mol FeS2在反应中将失去44mol e-,1mol FeS2在反应中将失去11mol e-,故D错误;
故选A.
点评 本题考查了铁元素及其化合物性质的分析,氧化还原反应的电子转移计算,掌握反应特征和物质性质是解题关键,题目难度中等.

练习册系列答案
相关题目
20.在NH3、H2SO4的工业生产中,具有的共同点是( )
| A. | 使用催化剂 | B. | 使用尾气吸收装置 | ||
| C. | 使用H2作原料 | D. | 使用吸收塔设备 |
1.下列物质中,属于酚类的是 ( )
| A. | 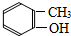 | B. | 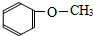 | C. | 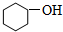 | D. | 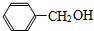 |
5.从防火、灭火、自救等安全知识判断,下列做法正确的是( )
| A. | 室内着火马上开门窗 | B. | 炒菜时油锅着火用锅盖盖灭 | ||
| C. | 用明火检验燃气是否泄漏 | D. | 电器着火时用水浇灭 |
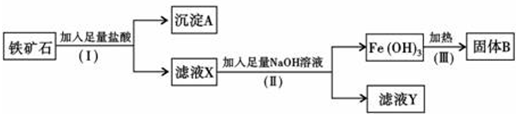
6.如表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na;
(2)最高价氧化物的水化物中碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A与H形成共价化合物(填“离子”或“共价”),用电子式表示它的形成过程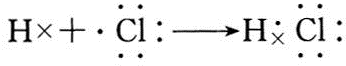 ;B与G形成离子化合物(填“离子”或“共价”),用电子式表示它的形成过程
;B与G形成离子化合物(填“离子”或“共价”),用电子式表示它的形成过程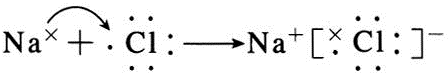 .
.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物中碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A与H形成共价化合物(填“离子”或“共价”),用电子式表示它的形成过程
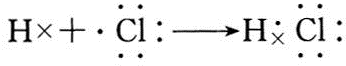 ;B与G形成离子化合物(填“离子”或“共价”),用电子式表示它的形成过程
;B与G形成离子化合物(填“离子”或“共价”),用电子式表示它的形成过程 .
. 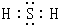 .
.
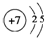 ,
,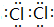 .
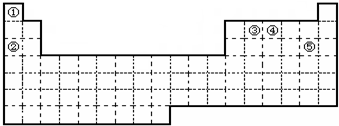
.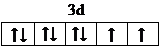 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①乙烯、②H乙炔、③苯、④甲醛.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是加成产物CH3OH分子之间能形成氢键(须指明加成产物是何物质)
,很多不饱和有机物在E催化下可与H2发生加成反应:如①乙烯、②H乙炔、③苯、④甲醛.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是加成产物CH3OH分子之间能形成氢键(须指明加成产物是何物质)