题目内容
6.向13.6由Cu和Cu2O组成的混合物中加入一定浓度的稀硝酸250mL,当固体物质完全溶解后生成Cu(NO3)2和NO气体.在所得溶液中加入0.5mol.L-1的NaOH溶液1.0L,生成沉淀质量为19.6g,此时溶液呈中性且金属离子已完全沉淀.下列有关说法正确的是( )| A. | 原固体混合物中Cu与Cu2O的物质的量之比为1:1 | |
| B. | 原稀硝酸中HNO3的物质的量浓度为1.3mol•L-l | |
| C. | 产生的NO的体积为2.24L | |
| D. | Cu、Cu2O与硝酸反应后剩余HNO3为0.1mol |
分析 向所得溶液中加入0.5mol/L 的NaOH溶液1L,溶液呈中性,金属离子已完全沉淀,此时溶液中溶质为NaNO3,n(NaNO3)=n(NaOH)=0.5mol/L×1L=0.5ml,沉淀为Cu(OH)2,质量为19.6g,其物质的量为:$\frac{19.6g}{98g/mol}$=0.2mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反应后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.2mol,
A.设Cu和Cu2O的物质的量分别为xmol、ymol,根据二者质量及关系式n(Cu)+2n(Cu2O)=n[Cu(OH)2],列方程计算,然后计算出Cu和O的物质的量之比;
B.根据N元素守恒可知原硝酸溶液n(HNO3)=n(NO)+n(NaNO3),根据A计算的Cu和Cu2O的物质的量,利用电子转移守恒计算n(NO),根据Na元素可知n(NaNO3)=n(NaOH),再根据c=$\frac{n}{V}$计算;
C.根据A计算的Cu和Cu2O的物质的量,利用电子转移守恒计算n(NO),再根据V=nVm计算NO标况下的体积;
D.反应后的溶液中加入氢氧化钠溶液,氢氧化钠与硝酸铜反应,剩余的氢氧化钠与硝酸反应,最后为硝酸钠溶液,根据氮元素守恒可知反应后溶液中n(HNO3)+2n[[Cu(NO3)2]=n(NaNO3),据此计算.
解答 解:向所得溶液中加入0.5mol/L 的NaOH溶液1L,溶液呈中性,金属离子已完全沉淀,此时溶液中溶质为NaNO3,n(NaNO3)=n(NaOH)=0.5mol/L×1L=0.5ml,沉淀为Cu(OH)2,质量为19.6g,其物质的量为:$\frac{19.6g}{98g/mol}$=0.2mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反应后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.2mol,
A.设Cu和Cu2O的物质的量分别为xmol、ymol,根据二者质量有 64x+144y=13.6,根据铜元素守恒有x+2y=0.2,联立方程解得x=0.1,y=0.05,则:n(Cu):n(Cu2O)=0.1mol:0.05mol=2:1,故A错误;
B.根据N元素守恒可知n(HNO3)=n(NO)+n(NaNO3),根据电子转移守恒可知:3n(NO)=2n(Cu)+2n(Cu2O),所以3n(NO)=2×0.1mol+2×0.05mol,解得n(NO)=0.1mol,根据Na元素可知n(NaNO3)=n(NaOH)=0.5mol/L×1L=0.5ml,所以n(HNO3)=n(NO)+n(NaNO3)=0.1mol+0.5mol=0.6mol,所以原硝酸溶液的浓度为:$\frac{0.6mol}{0.25L}$=2.4mol/L,故B错误;
C.由B中计算可知n(NO)=0.1mol,所以标准状况下NO的体积为:0.1mol×22.4L/mol=2.24L,故C错误;
D.反应后的溶液中加入氢氧化钠溶液,氢氧化钠与硝酸铜反应,剩余的氢氧化钠与硝酸反应,最后为硝酸钠溶液,根据氮元素守恒可知反应后溶液中n(HNO3)+2n[[Cu(NO3)2]=n(NaNO3),所以n(HNO3)=n(NaNO3)-2n[[Cu(NO3)2]=0.5mol-2×0.2mol=0.1mol,故D正确;
故选D.
点评 本题考查铜及其化合物知识、氧化还原反应的计算,题目难度较大,明确反应过程、充分利用守恒计算是解题的关键,试题培养了学生的分析、理解能力及化学计算能力.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案| A. | 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| B. | 铜片与浓硝酸:Cu+NO3-+4H+═Cu2++NO2↑+2H2O | |
| C. | 氯化铵浓溶液跟浓NaOH溶液混合后加热:NH4++OH-═NH3•H2O | |
| D. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-═NH3↑+H2O |
| A. | 浓度为0.1mol•L-1 CH3COOH溶液,加水稀释,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 浓度为0.1mol•L-1 CH3COOH溶液,升高温度,Ka (CH3COOH)不变,但醋酸的电离程度增大 | |
| C. | 在稀AgNO3溶液中先加入过量0.1mol/L NaCl溶液,再加入少量0.1mol/L Na2S溶液,先产生白色沉淀,后出现黑色沉淀,说明Ksp(AgCl)>Ksp(Ag2S) | |
| D. | 在恒容密闭容器中,反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0达到平衡后,使用高效催化剂,正反应速率增加,逆反应速率减小,平衡正向移动 |
①NaOH; ②AgNO3; ③Na2CO3; ④NaBr; ⑤FeCl2.
| A. | 只有②④ | B. | 只有④⑤ | C. | 只有②④⑤ | D. | 全部 |
| A. | 氢氧化钡溶液与稀硫酸混合:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 少量SO2通入到漂白粉溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| C. | 氯化铝溶液与过量的氨水反应:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 往明矾溶液中加入氢氧化钡溶液至SO42-完全沉淀:Al3++2SO42-+2 Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
 某学生用一支底部有破洞的试管和一个广口瓶组装成制CO2的装置(如图所示),在铜网上应盛放大理石或石灰石,广口瓶中应盛有稀盐酸.若将铜网换成铁网,那么产生的后果是制得CO2不纯,其原因是(用化学方程式表示)Fe+2HCl=FeCl2+H2↑.
某学生用一支底部有破洞的试管和一个广口瓶组装成制CO2的装置(如图所示),在铜网上应盛放大理石或石灰石,广口瓶中应盛有稀盐酸.若将铜网换成铁网,那么产生的后果是制得CO2不纯,其原因是(用化学方程式表示)Fe+2HCl=FeCl2+H2↑.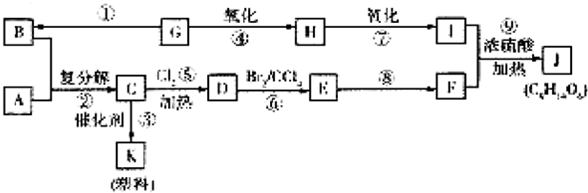
 +Br2$\stackrel{CCl_{4}}{→}$
+Br2$\stackrel{CCl_{4}}{→}$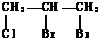 .
.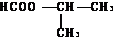 .
. .
.