题目内容
1.A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有5个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和.(1)请写出B、C元素的名称:B、C氧、钠.
(2)C、D两元素形成的化合物C2D是离子化合物(填“离子”或“共价”),写出物质E的电子式
 .
.(3)在同主族氢化物的递变性质中,A的氢化物沸点反常,这可以用C解释.
A.共价键 B.离子键 C.氢键 D.分子间作用力
(4)工业上制备D的最高价氧化物对应水化物的设备依次是沸腾炉、接触室、吸收塔.
(5)把盛有48mL AB、AB2混合气体的容器倒置于水中,待液面稳定后,容器内气体体积变为24mL(同温、同压下测定),则原混合气体中AB的体积分数为25%.
分析 A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有5个电子,则A为N元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素,据此解答.
解答 解:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有5个电子,则A为N元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素,
(1)根据上面的分析,B为氧元素、C为钠元素,故答案为:氧、钠;
(2)C、D两元素形成的化合物为Na2O,是离子化合物,E为Na2O2,E的电子式为 ,
,
故答案为:离子; ;
;
(3)A为N元素,在同主族氢化物的递变性质中,A的氢化物沸点反常,是因为氨分子之间有氢键,故选C;
(4)D为S元素,工业上制备硫酸的设备依次是沸腾炉、接触室、吸收塔,故答案为:沸腾炉、接触室、吸收塔;
(5)把盛有48mL NO、NO2混合气体的容器倒置于水中,待液面稳定后,容器内气体体积变为24mL,体积减小了24mL,根据NO2与水反应的关系式3NO2~NO可知,原混合气体中NO2的体积为$\frac{3}{2}$×24mL=36mL,所以原混合气体中NO的体积为12mL,原混合气体中NO的体积分数为$\frac{12mL}{48mL}$×100%=25%,
故答案为:25%.
点评 本题考查结构性质位置关系应用,侧重对化学用语的考查,比较基础,注意对基础知识的积累掌握.

| A. | 乘火车时携带鞭炮 | |
| B. | 用拇指堵住验纯后的试管口一会儿,再收集氢气 | |
| C. | 煤矿工人在矿井中吸烟 | |
| D. | 发现厨房中液化石油气泄漏后,立即打开窗子通风 |
| A. | 标准状况下,11.2L 己烷含有的分子数为0.5NA | |
| B. | 1 mol 羟基(-OH)含有的电子数为10NA | |
| C. | 1 mol 氯气参加反应时,电子转移数目一定为2NA | |
| D. | 10 g H218O 含有的中子数为5NA |
| A. | 78g苯含有C=C双键的数目为3NA | |
| B. | 1L 0.1mol/L的NaClO溶液中含有ClO-的数目为0.1NA | |
| C. | 常温常压下,14g由N2和CO组成的混合气体含有的原子数为NA | |
| D. | 标准状况下,6.72L NO2与水反应转移电子数为0.1NA |
| 化学式 | 电离常数(298K) |
| H3BO3 | K=5.7×10-10 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| CH3COOH | K=1.75×10-5 |
| A. | 等物质的量浓度的硼酸溶液和碳酸氢钠溶液比较,pH:后者>前者 | |
| B. | 等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者 | |
| C. | 将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生 | |
| D. | 将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生 |
| A. | 原固体混合物中Cu与Cu2O的物质的量之比为1:1 | |
| B. | 原稀硝酸中HNO3的物质的量浓度为1.3mol•L-l | |
| C. | 产生的NO的体积为2.24L | |
| D. | Cu、Cu2O与硝酸反应后剩余HNO3为0.1mol |
 为检验Pb(NO3)2热分解的产物,有人用示意图中装置进行实验.(图中铁架台、铁夹和加热设备均略去)实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有少量液体X,集气瓶中收集到无色气体Y.(如图)
为检验Pb(NO3)2热分解的产物,有人用示意图中装置进行实验.(图中铁架台、铁夹和加热设备均略去)实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有少量液体X,集气瓶中收集到无色气体Y.(如图)
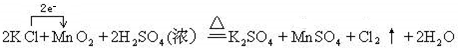 .
.