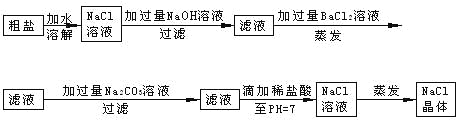
题目内容
【题目】在一定条件下,将3molA和1molB两种气体混合于2L恒容密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g)。2min末该反应达平衡,生成0.8molD,并测得C的浓度为0.2 mol·L-1。下列判断正确的是( )
xC(g)+2D(g)。2min末该反应达平衡,生成0.8molD,并测得C的浓度为0.2 mol·L-1。下列判断正确的是( )
A.x=2B.2min内B的反应速率为0.2 mol·L-1·min-1
C.A的转化率为40%D.若混合气体的密度不变,则表明该反应已达到平衡状态
【答案】C
【解析】
A、平衡时生成的C的物质的量为0.2mol·L-1×2L=0.4mol,物质的量之比等于化学计量数之比,故0.4mol:0.8mol=x:2,解得x=1,故A错误;
B、依据化学平衡三段式列式计算
3A(g)+B(g)![]() C(g)+2D(g)
C(g)+2D(g)
起始量(mol·L-1) 1.5 0.5 0 0
变化量(mol·L-1) 0.6 0.2 0.2 0.4
平衡量(mol·L-1) 0.9 0.3 0.2 0.4
2min内B的反应速率为v(D)=![]() =0.1 mol·L-1·min-1,故B错误;
=0.1 mol·L-1·min-1,故B错误;
C、A的转化率为![]() ×100%=40%,故C正确;
×100%=40%,故C正确;
D、因为容器体积不变,而反应前后气体质量守恒,则密度始终不变,则混合气体的密度不变时不能说明反应达到平衡状态,故D错误;
故选C。

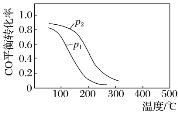
【题目】(1).用合成气生成甲醇的反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
CH3OH(g) ΔH,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①ΔH________(填“>”“<”或“= ”)0。
②写出一条可同时提高反应速率和CO转化率的措施:________________________。
③下列说法正确的是________(填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
④0~3 min内用CH3OH表示的反应速率v(CH3OH)=__________________。
⑤ 200 ℃时,该反应的平衡常数K=________。向上述200 ℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡________(填“正向”“逆向”或“不”)移动。