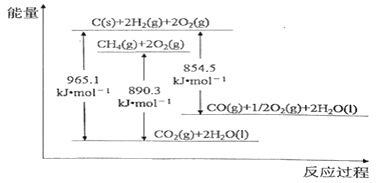
题目内容
【题目】下列说法正确的是( )
A.向0.1mol/L 100mL CH3COONa的溶液中再加0.1mol CH3COONa固体后c(CH3COO-)/c(Na+)变大
B.向0.1mol/L的二元弱酸盐Na2A中不断通入HCl(g),则c(H+)/c(H2A)先变大后变小
C.已知:FeCl3(aq)+ 3KSCN(aq)![]() 3KCl(aq)+Fe(SCN)3(aq),向该平衡体系中加入固体KCl后溶液颜色变浅
3KCl(aq)+Fe(SCN)3(aq),向该平衡体系中加入固体KCl后溶液颜色变浅
D.室温时,0.1mol/L NH4HCO3溶液pH=8.1,则Ka1(H2CO3) >Kb(NH3·H2O)>Ka2(H2CO3)
【答案】A
【解析】
A、向0.1mol/L 100mL CH3COONa的溶液中再加0.1mol CH3COONa,CH3COO-浓度变大,水解程度减小,c(CH3COO-)和c(Na+)均变大,但是c(CH3COO-)增大的幅度更大,因此加入固体后c(CH3COO-)/c(Na+)变大,故A正确;
B、向0.1mol/L的二元弱酸盐Na2A中不断通入HCl(g),根据 ,
, ,有氢离子先和A2-反应生成HA-,再与HA-反应生成H2A,HA-的浓度先增大后减小,则c(H+)/c(H2A)先变小后变大,故B错误;
,有氢离子先和A2-反应生成HA-,再与HA-反应生成H2A,HA-的浓度先增大后减小,则c(H+)/c(H2A)先变小后变大,故B错误;
C、已知:FeCl3(aq)+ 3KSCN(aq)![]() 3KCl(aq) +Fe(SCN)3(aq),向该平衡体系中加入固体KCl,反应实质为Fe3+ + SCN-
3KCl(aq) +Fe(SCN)3(aq),向该平衡体系中加入固体KCl,反应实质为Fe3+ + SCN-![]() Fe(SCN)3,因此加KCl,平衡不移动,故C错误;
Fe(SCN)3,因此加KCl,平衡不移动,故C错误;
D、室温时,0.1mol/L NH4HCO3溶液pH=8.1,显碱性,说明氨水的电离程度大于碳酸的电离程度,故D错误;
综上所述,答案为A。

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目