题目内容
【题目】甲醇是重要的化工原料,也是一种优质的燃料。
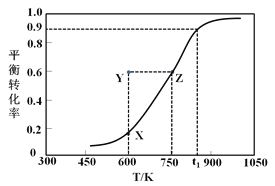
Ⅰ.甲醇脱氢制取甲醛的原理为CH3OH(g)![]() HCHO(g) +H2(g)。某科研小组在2 L密闭容器中充入1 mol CH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示。
HCHO(g) +H2(g)。某科研小组在2 L密闭容器中充入1 mol CH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示。
(1)下列选项中,能说明该反应达到平衡状态的是__________;
a.v(CH3OH) =v(HCHO) b.H2的体积分数不再变化
c.甲醛的质量分数不再改变 d.混合气体密度不变
(2)在t1时,该反应的平衡常数为K=________________,此温度下,从反应开始到平衡所经过的时间为5 s,则v(HCHO)为_______mol/(L·min)。向此容器中再通入1.1 mol CH3OH和1.1 mol H2,则平衡向_________(填“正反应”或“逆反应”)方向移动;
(3)600 K时,Y点甲醇的v(正)_______v(逆) (填“>”、“<”或“=”),理由是_____________________;
Ⅱ.已知:CH3OH(g) +CuO(s)=HCHO(g) +Cu(s)+H2O(g) ΔH1=-a kJ/mol;
2Cu(s)+O2(g)=2CuO(s) ΔH2=-b kJ/mol;
(4)则在铜作催化剂时:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) ΔH3=______kJ/mol(用含a,b的代数式表示);
Ⅲ.如图所示是以NaOH溶液为电解质溶液的甲醇燃料电池:

(5)a极电极反应式为__________________________,若隔膜为阴离子交换膜,则电池工作一段后,电池负极区溶液中n(OH-)_____(填“增大”、“减小”或“不变”)。
【答案】 bc 4.05mol/L 5.4 正反应 < Y点甲醇的转化率大于X点,反应向逆反应方向进行 -(2a+b) CH3OH+8OH--6e-=CO32-+6H2O 减小
【解析】Ⅰ.(1)a.没有指明正、逆速率,若均为正反应反应速率,二者反应速率始终相等,故a错误;b.随反应进行氢气的浓度增大,当H2的浓度不再变化时,说明到达平衡,故b正确;c.甲醛的质量分数不再改变,说明到达平衡,故c正确;d.混合气体总质量不变,容器体积不变,混合气体的密度始终不变,不能说明到达平衡,故d错误,故答案为bc;
(2)由图可知,t1K时甲醇的转化率为0.9,则参加反应甲醇的物质的量为0.9mol,容器体积为1L,则甲醇的起始浓度为1mol/L,浓度变化量为0.9mol/L,则:
CH3OH(g)![]() HCHO(g)+H2(g)
HCHO(g)+H2(g)
开始(mol):1 00
转化(mol):0.9 0.9 0.9
平衡(mol):0.1 0.9 0.9
故T1K时,平衡常数K=![]() =
=![]() =4.05,此温度下,从反应开始到平衡所经过的时间为5s,则v(HCHO)=
=4.05,此温度下,从反应开始到平衡所经过的时间为5s,则v(HCHO)=![]() =5.4mol/(L·min),达到平衡后若再向此容器中再通入1.1molCH3OH和1.1molH2,此时的浓度商Qc=
=5.4mol/(L·min),达到平衡后若再向此容器中再通入1.1molCH3OH和1.1molH2,此时的浓度商Qc=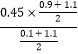 =0.083<K=4.05,平衡向正反应方向进行;
=0.083<K=4.05,平衡向正反应方向进行;
(3)由图可知,Y点的转化率高于相同温度下平衡点X的转化率,故Y点反应向逆反应方向移动,则v(正)<v(逆);
Ⅱ.(4)已知:①CH3OH(g) +CuO(s)=HCHO(g) +Cu(s)+H2O(g) ΔH1=-a kJ/mol;②2Cu(s)+O2(g)=2CuO(s) ΔH2=-b kJ/mol;根据盖斯定律由①×2+②可得2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g),则ΔH3=ΔH1×2+ΔH2=-(2a+b)kJ/mol;
Ⅲ.(5)燃料电池通氧气的极为正极,则b为正极,a为负极,负极上甲醇失电子发生氧化反应,在NaOH为电解质溶液时产物为CO32-,则a极电极反应式为CH3OH+8OH--6e-=CO32-+6H2O;若隔膜为阴离子交换膜,b极室OH-透过阴离子交换膜进入a极室,但每转移6mol电子,只能转移6molOH-,而a极室要消耗8molOH-,故电池工作一段后,电池负极区溶液中n(OH-)减小。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案【题目】下列说法正确的是( )
A.CS2是极性键构成的极性分子
B.SO2与CO2为等电子体
C.金属晶体的六方最密堆积和面心立方最密堆积的方式空间利用率最高
D.1molNaHSO4熔融态时有3mol离子
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法错误的是
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法错误的是
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1