题目内容
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用.二氧化硫有毒,并且是形成酸雨的主要气体.无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要.完成下列填空: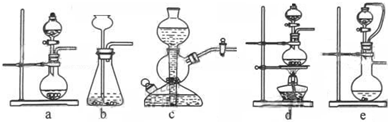
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫.
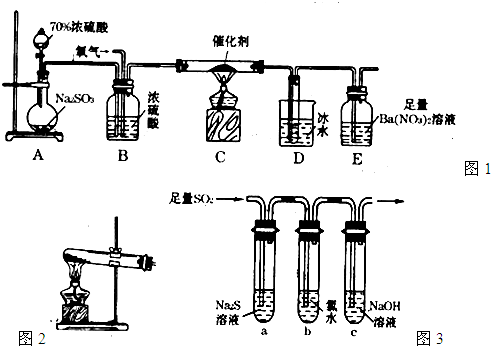
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,图中可选用的发生装置是______ (填写字母).
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠______g(保留一位小数);如果已有40%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠______g(保留一位小数).
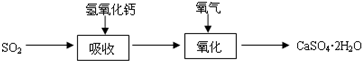
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.石灰-石膏法和碱法是常用的烟气脱硫法.石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4?2H2O.其流程如图:
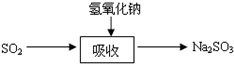
碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.其流程如图:
已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示).
解:(1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率,结合装置可知a、e可达到目的;
故答案为:ae;
(2)由硫守恒可得:Na 2SO3~SO2,因此需称取m(Na2SO3)=126g?mol-1×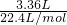 =18.9g;4g亚硫酸氧化为硫酸钠后质量变为
=18.9g;4g亚硫酸氧化为硫酸钠后质量变为 =4.5g,则有4.0%亚硫酸钠被氧化为硫酸钠的样品中亚硫酸钠的质量分数为:
=4.5g,则有4.0%亚硫酸钠被氧化为硫酸钠的样品中亚硫酸钠的质量分数为: ×100%=95.5%,因此称取变质样品的质量应为:18.9g÷95.5%=19.8g;
×100%=95.5%,因此称取变质样品的质量应为:18.9g÷95.5%=19.8g;
故答案为:18.9 19.8;
(3)石灰-石膏法与碱法吸收SO2都是利用SO2是酸性氧化物可与碱反应的性质来吸收SO2的;利用题中已知和有关信息可知采用石灰-石膏法所用原料易得、成本低等,但因Ca(OH)2碱性弱,导致吸收速率慢、效率低;
故答案为:利用SO2是酸性氧化物,可与碱反应,原料易得,吸收成本低;亚硫酸钙在输送中容易造成管道堵塞,吸收速率慢,效率低;
(4)依据上述流程操作存在的缺点,能实现物料循环的烟气脱硫方案 ;
;
故答案为: ;
;
分析:(1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率,结合装置可知a、e可达到目的;
(2)由硫守恒可得:Na 2SO3~SO2,因此需称取m(Na2SO3)=126g?mol-1×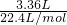 L?mol-1=18.9g;4g亚硫酸氧化为硫酸钠后质量变为
L?mol-1=18.9g;4g亚硫酸氧化为硫酸钠后质量变为 =4.5g,则有4.0%亚硫酸钠被氧化为硫酸钠的样品中亚硫酸钠的质量分数为:
=4.5g,则有4.0%亚硫酸钠被氧化为硫酸钠的样品中亚硫酸钠的质量分数为: ×100%=95.5%,因此称取变质样品的质量应为:18.9g÷95.5%=19.8g;
×100%=95.5%,因此称取变质样品的质量应为:18.9g÷95.5%=19.8g;
(3)石灰-石膏法与碱法吸收SO2都是利用SO2是酸性氧化物可与碱反应的性质来吸收SO2的;利用题中已知和有关信息可知采用石灰-石膏法所用原料易得、成本低等,但因Ca(OH)2碱性弱,导致吸收速率慢、效率低;
(4)流程中的氢氧化钠可以循环使用;
点评:本题考查了制备气体实验装置的选择原则,化学方程式和原子守恒的计算应用,流程分析和设计方法和理解,题目难度较大.
故答案为:ae;
(2)由硫守恒可得:Na 2SO3~SO2,因此需称取m(Na2SO3)=126g?mol-1×
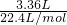 =18.9g;4g亚硫酸氧化为硫酸钠后质量变为
=18.9g;4g亚硫酸氧化为硫酸钠后质量变为 =4.5g,则有4.0%亚硫酸钠被氧化为硫酸钠的样品中亚硫酸钠的质量分数为:
=4.5g,则有4.0%亚硫酸钠被氧化为硫酸钠的样品中亚硫酸钠的质量分数为: ×100%=95.5%,因此称取变质样品的质量应为:18.9g÷95.5%=19.8g;
×100%=95.5%,因此称取变质样品的质量应为:18.9g÷95.5%=19.8g;故答案为:18.9 19.8;
(3)石灰-石膏法与碱法吸收SO2都是利用SO2是酸性氧化物可与碱反应的性质来吸收SO2的;利用题中已知和有关信息可知采用石灰-石膏法所用原料易得、成本低等,但因Ca(OH)2碱性弱,导致吸收速率慢、效率低;
故答案为:利用SO2是酸性氧化物,可与碱反应,原料易得,吸收成本低;亚硫酸钙在输送中容易造成管道堵塞,吸收速率慢,效率低;
(4)依据上述流程操作存在的缺点,能实现物料循环的烟气脱硫方案
 ;
;故答案为:
 ;
;分析:(1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率,结合装置可知a、e可达到目的;
(2)由硫守恒可得:Na 2SO3~SO2,因此需称取m(Na2SO3)=126g?mol-1×
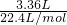 L?mol-1=18.9g;4g亚硫酸氧化为硫酸钠后质量变为
L?mol-1=18.9g;4g亚硫酸氧化为硫酸钠后质量变为 =4.5g,则有4.0%亚硫酸钠被氧化为硫酸钠的样品中亚硫酸钠的质量分数为:
=4.5g,则有4.0%亚硫酸钠被氧化为硫酸钠的样品中亚硫酸钠的质量分数为: ×100%=95.5%,因此称取变质样品的质量应为:18.9g÷95.5%=19.8g;
×100%=95.5%,因此称取变质样品的质量应为:18.9g÷95.5%=19.8g;(3)石灰-石膏法与碱法吸收SO2都是利用SO2是酸性氧化物可与碱反应的性质来吸收SO2的;利用题中已知和有关信息可知采用石灰-石膏法所用原料易得、成本低等,但因Ca(OH)2碱性弱,导致吸收速率慢、效率低;
(4)流程中的氢氧化钠可以循环使用;
点评:本题考查了制备气体实验装置的选择原则,化学方程式和原子守恒的计算应用,流程分析和设计方法和理解,题目难度较大.

练习册系列答案
相关题目

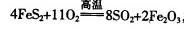 ,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。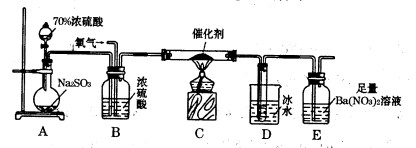


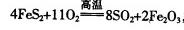 ,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。