题目内容
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2: ,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
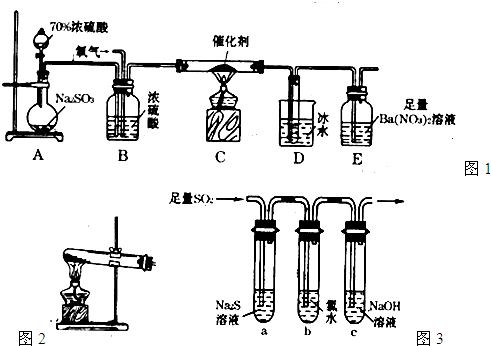
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16. 8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。) 
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是 。
②实验过程中,需要通入氧气。试写出一个用右图所示装置制取氧气的化学方程式 。
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是 。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如右图装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验: 
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。)】
(18分)(1)S、Fe(2分); 11.2 (2分)
(2)①打开分液漏斗上的活塞,旋开分液漏斗的旋塞,缓慢滴加。(2分)
②2KMnO4 K2MnO4+MnO2+O2 ↑或2KClO3
K2MnO4+MnO2+O2 ↑或2KClO3 2KCl+3O2↑(2分)
2KCl+3O2↑(2分)
③使残留在装置中的二氧化硫和三氧化硫被充分吸收。(2分) ④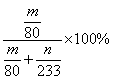 (2分)
(2分)
( 3 ) ①a试管中有淡黄色沉淀生成。(1分)
②Ⅲ合理(1分), Cl2+SO2+2H2O=4H++2Cl-+SO42-(2分)
③c(Na+)="2" C(SO32-)+ C(HSO3-) (2分)
解析试题分析:(1)根据方程式可知,S元素的化合价从-1价升高到+4价,失去5个电子。铁元素的化合价从+2价升高到+3价,失去1个电子,所以该反应中被氧化的元素是S和Fe。1mol还原剂失去11mol电子,得到2molSO2,所以当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为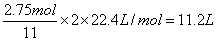 。
。
(2)①要使分液漏斗中的液体顺利滴下,则要首先打开打开分液漏斗上的活塞,所以正确的操作是打开分液漏斗上的活塞,旋开分液漏斗的旋塞,缓慢滴加。
②根据装置的特点可知,该装置适合于固体和固体加热制备气体的,所以应该的化学方程式应该是2KMnO4 K2MnO4+MnO2+O2 ↑或2KClO3
K2MnO4+MnO2+O2 ↑或2KClO3 2KCl+3O2↑。
2KCl+3O2↑。
③由于装置中还残留没有被吸收的SO2和三氧化硫,因此需要继续通一段时间的氧气的目的是使残留在装置中的二氧化硫和三氧化硫被充分吸收。
④D装置增加的质量是三氧化硫的的质量,E中产生的白色沉淀是硫酸钡,则根据S原子守恒可知,SO2的转化率应该是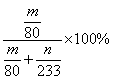 。
。
(3)①SO2具有氧化性,能把硫离子氧化生成单质S沉淀,所以能说明二氧化硫具有氧化性的实验现象为a试管中有淡黄色沉淀生成。
②氯水中移动含有氯离子,和硝酸银溶液一定生成白色沉淀,方案I不正确;氯水还具有强氧化性,能使品红溶液褪色,则方案Ⅱ也不正确;向第三份溶液加入BaCl2溶液,产生白色沉淀,白色沉淀一定是硫酸钡,即SO2被氧化生成硫硫酸,所以方案Ⅲ合理。反应的方程式是Cl2+SO2+2H2O=4H++2Cl-+SO42-。
③根据电荷守恒可知c(H+)+c(Na+)=2c(SO32-)+ c(HSO3-)+c(OH-),由于溶液显中性,则c(H+)=c(OH-),所以c(Na+)=2c(SO32-)+ c(HSO3-)。
考点:考查氧化还原反应的判断和计算,基本实验操作、氧气的制备,SO2性质的探究以及溶液中离子浓度的关系和有关计算
点评:该题是高考中的常见题型,难度大,综合性强,对学生的要求高。试题在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生规范严谨的实验设计能力以及评价能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。

 8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2.
75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2.
75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。


 ,该反应中被氧化的元素是________(填元素符号)。
,该反应中被氧化的元素是________(填元素符号)。
 ,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。

