题目内容
(2013?江苏二模)铜、碳、氮、硫、氯等是组成物质的重要元素.
(1)S、Cl组成的一种化合物的分子结构与H2O2相似,则此化合物的结构式为
N、O、S三种元素的电负性由大到小的顺序为
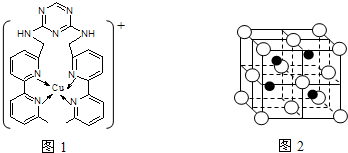
(2)铜离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点.某化合物Y 与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子:
①写出Cu(Ⅰ)的电子排布式
②该离子中含有化学键的类型有
A.极性键 B.离子键 C.非极性键 D.配位键
③该离子中C原子的杂化方式有
(3)向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,M的结构如图2所示.写出该反应的离子方程式

(1)S、Cl组成的一种化合物的分子结构与H2O2相似,则此化合物的结构式为
Cl-S-S-Cl
Cl-S-S-Cl
.N、O、S三种元素的电负性由大到小的顺序为
O>N>S(或O、N、S)
O>N>S(或O、N、S)
.(2)铜离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点.某化合物Y 与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子:
①写出Cu(Ⅰ)的电子排布式
1s22s22p63s23p63d10(或[Ar]3d10)
1s22s22p63s23p63d10(或[Ar]3d10)
;②该离子中含有化学键的类型有
ACD
ACD
(选填序号);A.极性键 B.离子键 C.非极性键 D.配位键
③该离子中C原子的杂化方式有
sp2sp3
sp2sp3
.(3)向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,M的结构如图2所示.写出该反应的离子方程式
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+
.分析:(1)根据双氧水分子的结构式确定该物质分子的结构式,注意每个原子都达到稳定结构,同一周期中,元素的电负性随着原子序数的增大而增大,同一主族中,元素的电负性随着原子序数的增大而减小;
(2)①根据能量最低原理和洪特规则书写电子排布式;
②同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,含有孤电子对的原子和含有空轨道的原子间存在配位键;
③根据价层电子对互斥理论确定碳原子杂化方式;
(3)利用均摊法确定M的化学式,铜离子和二氧化硫能发生氧化还原反应生成亚铜离子和硫酸根离子.
(2)①根据能量最低原理和洪特规则书写电子排布式;
②同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,含有孤电子对的原子和含有空轨道的原子间存在配位键;
③根据价层电子对互斥理论确定碳原子杂化方式;
(3)利用均摊法确定M的化学式,铜离子和二氧化硫能发生氧化还原反应生成亚铜离子和硫酸根离子.
解答:解:(1)S2Cl2分子结构与H2O2相似,S2Cl2分子中氯原子与硫原子之间形成1对共用电子对,硫原子与硫原子之间形成1对共用电子对,所以其结构式为:Cl-S-S-Cl;
同一周期中,元素的电负性随着原子序数的增大而增大,同一主族中,元素的电负性随着原子序数的增大而减小,所以这三种元素的电负性大小顺序是:O>N>S(或O、N、S),
故答案为:Cl-S-S-Cl,O>N>S(或O、N、S);
(2)①Cu的电子排布式为1s22s22p63s23p63d104s1,失去一个电子后生成Cu+,其电子排布式为1s22s22p63s23p63d10,
故答案为:1s22s22p63s23p63d10;
②该离子中,氮原子和氮原子之间、碳原子和碳原子之间都存在非极性键,碳原子和氮原子之间、氮原子和氢原子之间、碳原子和氢原子之间都存在极性键,铜原子和氮原子间存在配位键,故选A、C、D;
③苯环上的碳原子含有3个共价单键,采用sp2杂化,甲基上碳原子含有4个共价单键,采用sp3杂化,
故答案为:sp2 sp3;
(3)根据晶胞结构知,白色小球个数=8×
+6×
=4,黑色小球个数=4,所以该化合物的化学式为:CuCl,二氧化硫有还原性,铜离子有氧化性,所以二氧化硫和氯化铜发生氧化还原反应生成氯化亚铜和硫酸,离子反应方程式为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+,
故答案为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+.
同一周期中,元素的电负性随着原子序数的增大而增大,同一主族中,元素的电负性随着原子序数的增大而减小,所以这三种元素的电负性大小顺序是:O>N>S(或O、N、S),
故答案为:Cl-S-S-Cl,O>N>S(或O、N、S);
(2)①Cu的电子排布式为1s22s22p63s23p63d104s1,失去一个电子后生成Cu+,其电子排布式为1s22s22p63s23p63d10,
故答案为:1s22s22p63s23p63d10;
②该离子中,氮原子和氮原子之间、碳原子和碳原子之间都存在非极性键,碳原子和氮原子之间、氮原子和氢原子之间、碳原子和氢原子之间都存在极性键,铜原子和氮原子间存在配位键,故选A、C、D;
③苯环上的碳原子含有3个共价单键,采用sp2杂化,甲基上碳原子含有4个共价单键,采用sp3杂化,
故答案为:sp2 sp3;
(3)根据晶胞结构知,白色小球个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+.
点评:本题考查物质结构和性质,原子杂化方式的判断、化学式的确定等都是考试热点,难度中等.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
