题目内容
【题目】Fe、Cu、Mn三种元素的单质及化合物在生产、生活中有广泛应用.
![]()
![]() 是一种多功能材料,工业上常以
是一种多功能材料,工业上常以![]() 和尿素
和尿素![]() 、氧化剂等为原料制备.尿素分子中碳原子的杂化轨道类型为 ______ ,lmol尿素分子中含有的
、氧化剂等为原料制备.尿素分子中碳原子的杂化轨道类型为 ______ ,lmol尿素分子中含有的![]() 键数为 ______ .
键数为 ______ .
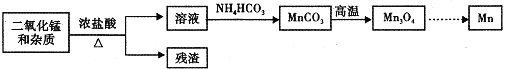
![]() 某学习小组拟以废旧于电池为原料制取锰,简易流程如下:
某学习小组拟以废旧于电池为原料制取锰,简易流程如下:
![]() 用浓盐酸溶解二氧化锰需保持通风,原因是 ______
用浓盐酸溶解二氧化锰需保持通风,原因是 ______ ![]() 用化学方程式表示
用化学方程式表示![]() .
.
![]() 写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 ______ .
写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 ______ .
![]() 基态铜原子的电子排布式为 ______ ,与Cu同周期且原子序数最小的第Ⅷ族元素,其基态原子核外有 ______ 个未成对电子.
基态铜原子的电子排布式为 ______ ,与Cu同周期且原子序数最小的第Ⅷ族元素,其基态原子核外有 ______ 个未成对电子.
![]() 图1是
图1是![]() 的晶胞结构,晶胞的边长为
的晶胞结构,晶胞的边长为![]() 则
则![]() 的密度为 ______
的密度为 ______ ![]() 用
用![]() 表示阿伏加德罗常数的值
表示阿伏加德罗常数的值![]() .
.
![]() 绿矾
绿矾![]() 是补血剂的原料,保存不当易变质.请设计实验检验绿矾是否完全变质 ______ .
是补血剂的原料,保存不当易变质.请设计实验检验绿矾是否完全变质 ______ .
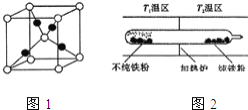
![]() 以羰基化合物为载体,提纯某纳米级活性铁粉
以羰基化合物为载体,提纯某纳米级活性铁粉![]() 含有一些不反应的杂质
含有一些不反应的杂质![]() ,反应装置如图
,反应装置如图![]() 已知:
已知:![]() ,常压下,
,常压下,![]()
![]() 的熔点约为
的熔点约为![]() ,沸点为
,沸点为![]() ,则
,则![]()
![]() 的晶体类型为 ______
的晶体类型为 ______ ![]() 请用平衡移动原理解释
请用平衡移动原理解释![]() 的原因 ______ .
的原因 ______ .
【答案】![]()
![]()
![]() 浓
浓![]()
![]()
![]() 4
4 ![]() 取样品溶于水,滴加酸性高锰酸钾溶液,如溶液褪色,则表示样品没有完全变质
取样品溶于水,滴加酸性高锰酸钾溶液,如溶液褪色,则表示样品没有完全变质![]() 或滴加铁氰化钾溶液,产生蓝色沉淀,则样品没有完全变质 分子晶体 铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到高温区
或滴加铁氰化钾溶液,产生蓝色沉淀,则样品没有完全变质 分子晶体 铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到高温区![]() 时,即升温平衡逆向移动,羰基合铁分解,纯铁粉残留在右端,故
时,即升温平衡逆向移动,羰基合铁分解,纯铁粉残留在右端,故![]()
【解析】
![]() 尿素分子中C原子形成3个
尿素分子中C原子形成3个![]() 键、没有孤对电子,杂化轨道数目为3,每个分子中含有7个
键、没有孤对电子,杂化轨道数目为3,每个分子中含有7个![]() 键。
键。
![]() 盐酸与二氧化锰在加热条件下反应产生氯气,滤液中含有二氯化锰,加入碳酸铵可生成碳酸锰,经高温生成
盐酸与二氧化锰在加热条件下反应产生氯气,滤液中含有二氯化锰,加入碳酸铵可生成碳酸锰,经高温生成![]() ,最后用热还原法生成Mn。
,最后用热还原法生成Mn。
![]() 氯气是有毒气体,要保持通风,避免中毒;
氯气是有毒气体,要保持通风,避免中毒;
![]() 碳酸锰在空气中灼烧时有氧气参与反应,同时生成二氧化碳;
碳酸锰在空气中灼烧时有氧气参与反应,同时生成二氧化碳;
![]() 铜原子核外电子数为29,根据能量最低原理书写电子排布式;与Cu同周期且原子序数最小的第Ⅷ族元素为Fe,其基态原子核外电子排布式为
铜原子核外电子数为29,根据能量最低原理书写电子排布式;与Cu同周期且原子序数最小的第Ⅷ族元素为Fe,其基态原子核外电子排布式为![]() ;
;
![]() 根据均摊法计算晶胞中白色球、黑色球数目,结合化学式判断晶胞中Cu、O原子数目,再计算晶胞质量,根据
根据均摊法计算晶胞中白色球、黑色球数目,结合化学式判断晶胞中Cu、O原子数目,再计算晶胞质量,根据![]() 计算晶胞密度;
计算晶胞密度;
![]() 绿矾变质时亚铁离子被氧化为铁离子,检验绿矾是否完全变质可以检验是否含有亚铁离子;
绿矾变质时亚铁离子被氧化为铁离子,检验绿矾是否完全变质可以检验是否含有亚铁离子;
![]() 的熔沸点低,应属于分子晶体;
的熔沸点低,应属于分子晶体;
铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到高温区![]() 时,即升温平衡逆向移动,羰基合铁分解,纯铁粉残留在右端。
时,即升温平衡逆向移动,羰基合铁分解,纯铁粉残留在右端。
![]() 尿素分子的结构简式为
尿素分子的结构简式为![]() ,杂化轨道数目为3,所以尿素分子中碳原子的杂化方式为
,杂化轨道数目为3,所以尿素分子中碳原子的杂化方式为![]() 杂化,每个分子中含有7个
杂化,每个分子中含有7个![]() 键,所以1mol尿素中含有
键,所以1mol尿素中含有![]() 键,含有的
键,含有的![]() 键数为
键数为![]() 。答案为:
。答案为:![]() ;
;![]() ;
;
![]() 盐酸与二氧化锰在加热条件下反应产生氯气,滤液中含有二氯化锰,加入碳酸铵可生成碳酸锰,经高温生成
盐酸与二氧化锰在加热条件下反应产生氯气,滤液中含有二氯化锰,加入碳酸铵可生成碳酸锰,经高温生成![]() ,最后用热还原法生成Mn。
,最后用热还原法生成Mn。
![]() 浓盐酸与二氧化锰反应产生氯气,氯气是有毒气体,要保持通风,避免中毒,反应方程式为:
浓盐酸与二氧化锰反应产生氯气,氯气是有毒气体,要保持通风,避免中毒,反应方程式为:![]() 浓
浓![]() ;答案为:
;答案为:![]() 浓
浓![]() ;
;
![]() 碳酸锰在空气中灼烧时有氧气参与反应,同时生成二氧化碳,反应的方程式为
碳酸锰在空气中灼烧时有氧气参与反应,同时生成二氧化碳,反应的方程式为![]() 。答案为:
。答案为:![]() ;
;
![]() 铜原子核外电子数为29,核外电子排布式为
铜原子核外电子数为29,核外电子排布式为![]() ,与Cu同周期且原子序数最小的第Ⅷ族元素为Fe,其基态原子核外电子排布式为
,与Cu同周期且原子序数最小的第Ⅷ族元素为Fe,其基态原子核外电子排布式为![]() ,3d能级有4个未成对电子;答案为:
,3d能级有4个未成对电子;答案为:![]() ;4;
;4;
![]() 晶胞中白色球数目为
晶胞中白色球数目为![]() ,黑色球数目为4,故白色球为O原子、黑色球为Cu原子,晶胞质量为
,黑色球数目为4,故白色球为O原子、黑色球为Cu原子,晶胞质量为![]() ,则晶胞密度为
,则晶胞密度为![]() 。答案为:
。答案为:![]() ;
;
![]() 绿矾变质时亚铁离子被氧化为铁离子,实验检验绿矾是否完全变质方法为:取样品溶于水,滴加酸性高锰酸钾溶液,如溶液褪色,则表示样品没有完全变质
绿矾变质时亚铁离子被氧化为铁离子,实验检验绿矾是否完全变质方法为:取样品溶于水,滴加酸性高锰酸钾溶液,如溶液褪色,则表示样品没有完全变质![]() 或滴加铁氰化钾溶液,产生蓝色沉淀,则样品没有完全变质。答案为:取样品溶于水,滴加酸性高锰酸钾溶液,如溶液褪色,则表示样品没有完全变质
或滴加铁氰化钾溶液,产生蓝色沉淀,则样品没有完全变质。答案为:取样品溶于水,滴加酸性高锰酸钾溶液,如溶液褪色,则表示样品没有完全变质![]() 或滴加铁氰化钾溶液,产生蓝色沉淀,则样品没有完全变质;
或滴加铁氰化钾溶液,产生蓝色沉淀,则样品没有完全变质;
![]() 的熔沸点低,应属于分子晶体;铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到高温区
的熔沸点低,应属于分子晶体;铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到高温区![]() 时,即升温平衡逆向移动,羰基合铁分解,纯铁粉残留在右端,故
时,即升温平衡逆向移动,羰基合铁分解,纯铁粉残留在右端,故![]() ;答案为:分子晶体;铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到高温区
;答案为:分子晶体;铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到高温区![]() 时,即升温平衡逆向移动,羰基合铁分解,纯铁粉残留在右端,故
时,即升温平衡逆向移动,羰基合铁分解,纯铁粉残留在右端,故![]() 。
。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液; ⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是______(填编号)。若测定结果偏高,其原因可能是________(填字母)。
A.配制标准溶液的固体NaOH中混有KOH杂质 B.滴定终点读数时,仰视滴定管的刻度,其他操作正确 C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 D.所配的标准NaOH溶液物质的量浓度偏大
(2)判断滴定终点的现象是_____________________________________。
(3)如图是某次滴定时的滴定管中的液面,其读数为________mL。

(4)根据下列数据,请计算待测盐酸的浓度:________mol·L-1。
滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
(5)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已在H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
①用太阳能分解10 mol水消耗的能量是________kJ。
②CH3OH(l)不完全燃烧生成一氧化碳和液态水的热化学方程式为________________。