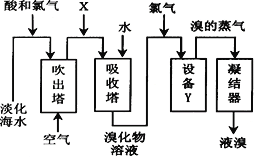
题目内容
【题目】下列说法正确的是()
A. ![]() 、
、 ![]() 是质量数和电子数相等的两种微粒,中子数也相等
是质量数和电子数相等的两种微粒,中子数也相等
B. ![]() 原子的质子数与中子数差50
原子的质子数与中子数差50
C. 35Cl和37Cl两者互为同位素
D. 当氘原子转变为氕原子发生了分解反应
【答案】B
【解析】
![]() 中子数是136、
中子数是136、 ![]() 中子数是134;
中子数是134;![]() 的质子数是86,中子数是222-86;同位素是指质子数相同、中子数不同的原子,37Cl是离子;氘原子转变为氕原子是核变,核变属于物理变化。
的质子数是86,中子数是222-86;同位素是指质子数相同、中子数不同的原子,37Cl是离子;氘原子转变为氕原子是核变,核变属于物理变化。
![]() 中子数是136、
中子数是136、 ![]() 中子数是134,中子数不同,故A错误;
中子数是134,中子数不同,故A错误;![]() 原子的质子数是86,中子数是222-86=136,中子数与质子数的差是50,故B正确;同位素是指质子数相同、中子数不同的原子,37Cl是离子,故C错误;氘原子转变为氕原子是核变,核变属于物理变化,故D错误。
原子的质子数是86,中子数是222-86=136,中子数与质子数的差是50,故B正确;同位素是指质子数相同、中子数不同的原子,37Cl是离子,故C错误;氘原子转变为氕原子是核变,核变属于物理变化,故D错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 将Na2CO3溶液由0.1mol/L 稀释到0.01mol/L,测溶渡pH | 溶液pH变小 | 稀释后CO32-的水解程度减小 |
B | 向一定浓度的CuSO4溶液中 通入适量的H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
C | 将盛有棕红色NO2气体的注射 器由10 mL 压缩至5 mL | 气体颜色比压 缩前变浅 | 反应2NO2 |
D | 在新生成的AgCl 沉淀中滴入 稀KI溶液,振荡 | 白色沉淀转化为 黄色沉淀 | Ksp (AgCl )>Ksp (AgI) |
A. A B. B C. C D. D