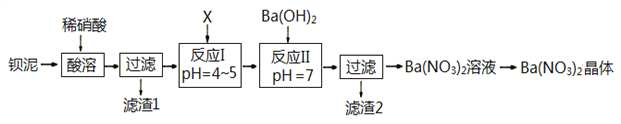
题目内容
【题目】用MnO2氧化密度为1.19g·cm-3、溶质质量分数为36.5%的HCl溶液。反应方程式如下:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式______________________________。
(2)该反应的氧化剂为_____________,氧化产物是___________。
(3)17.4gMnO2能与_____摩尔HCl发生上述反应?有______摩尔HCl被氧化?
(4)若在标准状况下产生4.48L Cl2,则反应中转移电子_______摩尔。
【答案】MnO2+4H++4Cl-![]() Mn2++Cl2↑+2H2O MnO2 Cl2 0.8 0.4 0.4
Mn2++Cl2↑+2H2O MnO2 Cl2 0.8 0.4 0.4
【解析】
(1)根据化学方程式书写离子方程式;
(2)得到电子的物质是氧化剂,还原剂中失去电子的元素被氧化得到氧化产物;
(3)根据n=m/M计算二氧化锰的物质的量,结合方程式计算;
(4)得到1分子氯气,转移2个电子,据此解答。
(1)反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,则该反应的离子方程式为MnO2+4H++4Cl-
MnCl2+Cl2↑+2H2O,则该反应的离子方程式为MnO2+4H++4Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)Mn元素化合价降低,得到电子,则该反应的氧化剂为MnO2。氯元素化合价升高,失去电子,HCl是还原剂,因此氧化产物是Cl2。
(3)17.4gMnO2的物质的量是17.4g÷87g/mol=0.2mol,根据方程式可知能与0.2mol×4=0.8molHCl发生上述反应,其中被氧化的HCl是参加反应的HCl的一半,即被氧化的HCl为0.4mol。
(4)标准状况下4.48LCl2的物质的量是4.48L÷22.4L/mol=0.2mol,反应中氯元素化合价从-1价升高到0价,即得到1分子氯气,转移2个电子,则反应中转移电子的物质的量是0.2mol×2=0.4mol。

【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
【题目】某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。已知:
①A 中反应为 KClO3+6HCl(浓) = KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为 Ca(OH)2,其他杂质不参与反应。
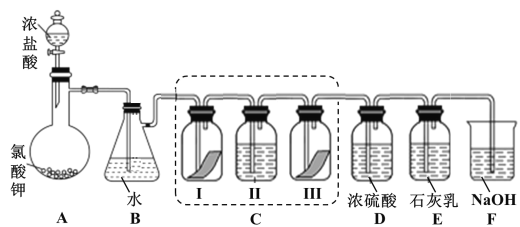
(1)写出 B 装置中反应的化学方程式_______________。实验结束后,立即将 B 中溶液滴几滴在紫色石蕊试纸上,可观察到的现象是______________
(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中 I、II、III 处依次放入的物质正确的是_________(填编号)。
编号 | I | II | III |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(3)待 E 中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其主要成份为_________、____________(填化学式)。
(4)F 装置的作用是(用离子方程式表示)_____________
(5)为测定(3)中所得漂白粉的有效成份含量。称取 a g 漂白粉样品溶解,往所得溶液中通入 CO2 至不再产生沉淀为止,该过程的化学方程式为_____________。若反应生成沉淀的物质的量为 b mol,则该漂白粉中有效成份的质量分数为_________________(用含 a、b 的式子表示)。