题目内容
【题目】氨基甲酸铵是一种重要化工产品,常温时,为白色晶体或粉末,易溶于水,难溶于CCl4,59℃时分解为氨及二氧化碳,其制备原理:2NH3(g)+CO2(g)![]() NH2COONH4(s)△H=-272kJ·mol-1。某化学兴趣小组利用下图实验装置(部分固定装置已省略)模拟制备NH2COONH4。试回答下列问题:
NH2COONH4(s)△H=-272kJ·mol-1。某化学兴趣小组利用下图实验装置(部分固定装置已省略)模拟制备NH2COONH4。试回答下列问题:

(1)仪器组装完毕后,首先应进行的操作是_____________________________。
(2)装置A用于实验室制取NH2COONH4的原料气体之一,该反应的化学方程式为_____________。
(3)装置F中试剂的名称为_________,装置G的作用为________________。
(4)为提高原料气的利用率,应控制装置C和E中最佳鼓泡速率比为____________,装置D采用冰水浴的原因为_____________________________________________________。
(5)生成的氨基甲酸铵悬浮于CCl4中,下列操作可实现产品分离的是_________。
![]()



(6)实验装置中存在明显不足之处的是______________,有同学认为装置H、G和F组成的装置过于复杂可简化,请简述该方法:__________________________。
【答案】 检查装置气密性 Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O 浓硫酸 除去CO2中混有的HCl杂质 2∶1 降低温度,有利于提高反应物的转化率(或降低温度,防止因反应放热造成NH2COONH4分解) C 缺少尾气处理装置 采用干冰升华直接制取纯净干燥的CO2
CaCl2+2NH3↑+2H2O 浓硫酸 除去CO2中混有的HCl杂质 2∶1 降低温度,有利于提高反应物的转化率(或降低温度,防止因反应放热造成NH2COONH4分解) C 缺少尾气处理装置 采用干冰升华直接制取纯净干燥的CO2
【解析】(1). 仪器组装完毕后必须先检查装置的气密性,故答案为:检查装置气密性;
(2). 装置A是实验室制取氨气的装置,该反应的化学方程式为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(3). 装置H、G和F分别为CO2的制取、净化和干燥装置,装置F中盛装的试剂是浓硫酸,装置G中盛装的是饱和NaHCO3溶液,作用是除去CO2中混有的HCl杂质,故答案为:浓硫酸;除去CO2中混有的HCl杂质;
(4) .由反应方程式2NH3(g)+CO2(g)![]() NH2COONH4(s)可知,NH3和CO2的最佳鼓泡速率比为2:1,制取NH2COONH4的反应为放热反应,装置D采用冰水浴可以降低温度,有利于提高反应物的转化率,并可以防止温度过高,使NH2COONH4分解,故答案为:2∶1;降低温度,有利于提高反应物的转化率(或降低温度,防止因反应放热造成NH2COONH4分解);
NH2COONH4(s)可知,NH3和CO2的最佳鼓泡速率比为2:1,制取NH2COONH4的反应为放热反应,装置D采用冰水浴可以降低温度,有利于提高反应物的转化率,并可以防止温度过高,使NH2COONH4分解,故答案为:2∶1;降低温度,有利于提高反应物的转化率(或降低温度,防止因反应放热造成NH2COONH4分解);
(5). 氨基甲酸铵固体难溶于CCl4,通过过滤操作可实现产品分离,故答案选:C;
(6). 因尾气中含有氨气等有害气体,必须进行处理后才能排放,防止污染空气,利用干冰易升华的特点,可以直接制取纯净干燥的二氧化碳,故答案为:缺少尾气处理装置;采用干冰升华直接制取纯净干燥的CO2。

【题目】镍废料中主要含有Ni,还有少量的Cu、Fe、Pb等。现从中制取Ni2O3,可用于制造人造卫星、宇宙飞船的高能电池,也可用于制成镍镉碱性电池。生产流程见下:

已知0.010mol/L金属离子在不同pH下的沉淀情况如下:
Fe3+ | Cu2+ | Ni2+ | Fe2+ | |
开始沉淀pH | 3.0 | 5.0 | 7.4 | 9.7 |
完全沉淀pH | 4.0 | 6.5 | 9.0 | 11 |
回答下列问题:
(1)加入碳酸钙调pH的目的是____________________________________________,“沉渣2”的主要成分是____________,必须先过滤“沉渣1”后再进行“除Cu”的原因是______________________________________________________________________。
(2)用离子方程式解释加入NH4F“除Ca”的过程_________________。
(3)“酸浸”时参与反应的H2SO4与HNO3物质的量比保持为3∶2,此时Ni单质所发生的化学方程式为___________________________________________。
(4)“操作X”是__________、__________,煅烧时产生两种气体的成分是________。
(5)向NiO中加入盐酸溶解,待完全溶解后,加入足量NaOH溶液,再加入NaClO溶液,写出其中和NaClO相关的反应的离子方程式为_________________________________。
(6)根据上表数据,计算当0.010mol/LNiSO4溶液中Ni2+完全沉淀时的c(Ni2+)=______mol/L。
【题目】除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是 ( )
Ⅰ.试剂:①KMnO4/H+②NaOH溶液 ③饱和Na2CO3溶液④H2O ⑤Na ⑥Br2/H2O ⑦Br2/CCl4
Ⅱ.装置:
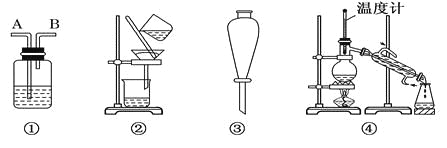
选项 | 物质 | 试剂 | 装置 |
A | C2H6(C2H4) | ⑥ | ① |
B | 苯(苯酚) | ① | ③ |
C | CH3COOC2H5(CH3COOH) | ③ | ② |
D | 甲苯(二甲苯) | ① | ③ |

