题目内容
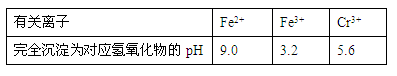
(4分)已知Ba(AlO2)2可溶于水。右图表示的是向KA1(SO4)2溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。完成下列问题:
(1)a点时反应的离子方程式是
(2)a、b两点消耗Ba(OH)2的物质的量之比是
(1)2Al3+ +3SO42- + 3Ba2+ + 6OH- = 2A1(OH)3↓+ 3BaSO4↓(2分)
(2)(3:4)(2分)
解析:
a点表示沉淀达到最大值,即Al3+完全生成氢氧化铝沉淀,Ba2+完全变成BaSO4沉淀,故离子方程式是2Al3+ +3SO42- + 3Ba2+ + 6OH- = 2A1(OH)3↓+ 3BaSO4↓,书写时注意离子配数比;(2)从a点到b点,发生的离子反应是A1(OH)3+OH-=AlO2-+2H20 ,故a点消耗3mol,b点消耗4mol,即3:4。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目