题目内容
(10分,每空2分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
有关离子完全沉淀的pH如下表: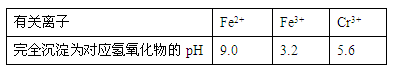
(1)写出Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式________________________________________________________。
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为:_____________(填序号);
A.Na2O2 B.Ca(OH)2 C.Ba(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.12~14 B.10~11 C.6~8 D.3~4
(3)将等体积的4.0×10-3mol·L-1的AgNO3和4.0×10-3mol·L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式(2分),并简要写出能生成Ag2CrO4沉淀原因的计算过程(2分)。
(每空2分,总计10分)
(1)Cr2O72— + 6Fe2+ +14H+ ="=" 2Cr3+ + 6Fe3+ + 7H2O。
(2)B C
(3)Ag2CrO4 (s)  2Ag+(aq) + CrO42—(aq)
2Ag+(aq) + CrO42—(aq)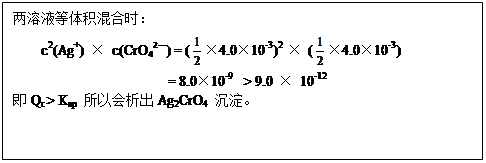
解析试题分析::(1)二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,二价铁离子被氧化成三价铁离子,Cr2O72-被还原为Cr3+,反应方程式为Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O。
故答案为:Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O。
(2)A.Na2O2有强氧化性,能把Cr3+氧化成Cr6+,从而得不到Cr(OH)3,故错误。
B.Ca(OH)2和 D.NaOH使Fe3+和Cr3+产生氢氧化物沉淀,且没有其它沉淀杂质生成,故正确。
C.Ba(OH)2和硫酸根离子能产生硫酸钡沉淀,生成杂质,故错误。
在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀,且没有氢氧化亚铁沉淀,所以溶液的PH应大于5.6小于9,所以B正确。
故答案为:B;C。
考点:物质分离和提纯的方法和基本操作综合应用制备实验方案的设计
点评:本题考查了离子方程式的书写,难度不大,注意题中的图示和表中所提供的信息,分析透彻题中所给出的信息解题的关键。

 阅读快车系列答案
阅读快车系列答案(10分,每空2分)决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离如下表所示:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
578 |
1 817 |
2 745 |
11 578 |
|
B |
738 |
1 451 |
7 733 |
10 540 |
A通常显____价,A的电负性__ __B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:
。
|
共价键 |
C—C |
C—N |
C—S |
|
键能/kJ·mol-1 |
347 |
305 |
259 |
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________________。
(4)某配合物的分子结构如图所示,其分子内不含有__________(填字母)。
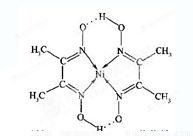
A.离子键 B.共价键
C.金属键 D.配位键 E.氢键
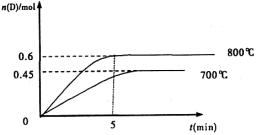
 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题: