题目内容
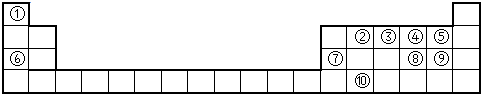
下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,用化学用语回答下列问题:
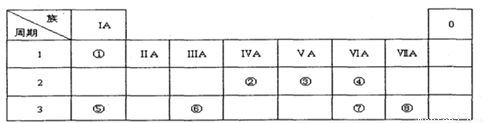
Ⅰ.(1)请画出元素⑧的阴离子结构示意图 。
(2)④、⑤、⑦的原子半径由小到大的顺序为 。
(3)⑤和⑥的最高价氧化物对应水化物的碱性强弱为 > 。
(4)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为 。
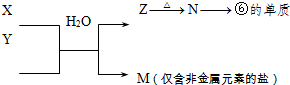
Ⅱ.由表中①一⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答:
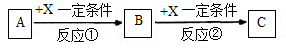
(1)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属离子的方法是 ;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式 。
(2)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为 ,写出A与C两溶液反应的离子方程式____ 。
Ⅰ.(1)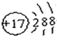 (1分)
(2)Na>S>O (2分)
(1分)
(2)Na>S>O (2分)
(3) NaOH >Al(HO)3 (2分) (4) 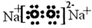 (2分)
(2分)
Ⅱ.(1)先加入KSCN溶液不显红色,再加入氯水显红色。(或加入氢氧化钠溶液,产生白色沉淀,然后变成灰绿色,最后变成红褐色。)。(2分)
H2O2+2Fe2++2H+=2Fe3++2H2O (2分)
(2)Al(OH)3 (1分) ; Al3++3AlO2-+6H2O=4Al(OH)3↓(2分)
【解析】
试题分析:Ⅰ.(1)通过图表信息可知,元素⑧为氯元素,氯原子的离子结构示意图为: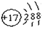 ,(2)④、⑤、⑦的元素分别为:O、Na、S三种元素,根据元素周期律,可得知三种元素的原子半径的大小关系为Na>S>(3)⑤是Na,⑥是Al,金属性Na>Al,金属性越强,则该金属的最高价氧化物对应水化物的碱性越强强,因此,NaOH >Al(HO)3。
,(2)④、⑤、⑦的元素分别为:O、Na、S三种元素,根据元素周期律,可得知三种元素的原子半径的大小关系为Na>S>(3)⑤是Na,⑥是Al,金属性Na>Al,金属性越强,则该金属的最高价氧化物对应水化物的碱性越强强,因此,NaOH >Al(HO)3。
Ⅱ. (1)由X是一种常见过渡金属单质,再根据向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,可推知X为Fe,A、B、C三种物质中含有氯元素,由此,不难推断本题考查Fe2+和Fe3+之间的转化,综合分析后可得出A:Cl2、B:FeCl3、FeCl2,检验Fe2+的方法是:先加入KSCN溶液不显红色,再加入氯水显红色。(或加入氢氧化钠溶液,产生白色沉淀,然后变成灰绿色,最后变成红褐色。在酸性溶液中该金属离子能被双氧水氧化的离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O。
(2)本题在作答时,先根据题意快速联想有关的金属元素及其化合物,符合转化关系图的由题可知,A是一种含有Al3+的盐,B是Al(OH)3,C是NaAlO2,A与C两溶液发生双水解反应:Al3++3AlO2-+6H2O=4Al(OH)3↓。
考点:考查元素周期表和元素周期律、电子式的书写、离子结构示意图、离子方程式的书写、无机推断。

 口算能手系列答案
口算能手系列答案


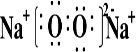






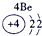



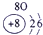

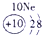






 表示的是
表示的是