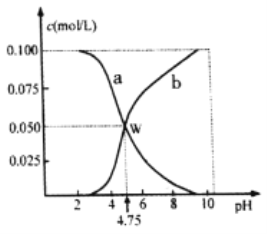
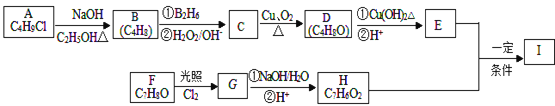
题目内容
【题目】I.某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝。回答下列问题:

(1)在实验中需用1 mol·L-1的NaOH溶液480 mL,配制该溶液已有下列仪器:烧杯、托盘天平(砝码)、胶头滴管、药匙、玻璃棒,还缺少的仪器是______________。
(2)写出步骤①中发生反应的离子方程式___________
(3)甲同学在实验室中用如图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象。
乙同学分析认为:甲同学通入CO2的量不足是导致实验失败的原因之一,你认为乙的分析是否合理?________。若合理,请用离子方程式解释其原因_________________________________(若你认为不合理,该空不作答)。

II.某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:_____________________________
(2)实验②的化学反应中转移电子的物质的量是_______________________。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是__________________________________________________________。
【答案】500mL容量瓶;Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O合理CO2+2OH-=CO32-+H2O2I-+ClO-+2H+=Cl-+I2+H2O4×10-3molClO->I2>SO42-
【解析】
I.(1)根据本实验的目的,实验室配制一定物质的量浓度的溶液中需要的仪器是烧杯、托盘天平、500mL容量瓶、药匙、玻璃棒、胶头滴管,因此缺少的仪器是500mL容量瓶;(2)Al2O3属于两性氧化物,Fe2O3属于碱性氧化物,SiO2属于酸性氧化物,SiO2不与盐酸反应,因此反应①中的离子反应方程式为Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O;(3)滤液B中有过量NaOH溶液存在,通入CO2气体,CO2先于NaOH反应,如果CO2少量,发生CO2+2OH-=CO32-+H2O,,因此该同学分析合理;II.(1)溶液变蓝,说明有I2的生成,利用ClO-的氧化性,把I-氧化成I2,其离子方程式为2I-+ClO-+2H+=Cl-+I2+H2O;(2)蓝色褪去,说明I2与Na2SO3发生氧化还原反应,SO32-被氧化成SO42-,即转移电子物质的量为4×10-3×0.5×(6-4)mol=4×10-3mol;(3)根据氧化还原反应的规律,①反应中ClO-为氧化剂,I2为氧化产物,即ClO-氧化性强于I2,②中I2为氧化剂,SO42-为氧化产物,即I2的氧化性强于SO42-,综上所述,氧化性:ClO->I2>SO42-。

【题目】在80 ℃时,将0.20 mol的N2O4气体充入1 L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间 /(s) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) / mol · L-1 | 0.20 | c1 | 0.10 | c2 | c3 | c4 |
c(NO2) / mol · L-1 | 0.00 | 0.12 | 0.20 | 0.22 | 0.22 | 0.22 |
根据本题内容和表中提供数据填空(c1、c2、c3、c4表示相应的浓度),请回答下列各小题:
(1)该反应化学方程式_________________________; 表中c2____c3(填“<”、“>”或“=”)
(2)c4=_______mol · L-1,在0~20 s内NO2的平均反应速率为______________________