题目内容
某物质A的产量可以用来衡量一个国家的石油化工发展水平。其 与水加成的产物B是一种常用的有机溶剂,在生活中有重要的应用。
(1)A的电子式为________,B的分子式为________。
若用B与O2制成燃料电池,并以稀硫酸溶液为电解质溶液,回答(2)-(5)题:
(2)负极上的电极反应式为_______________________________________。
(3)消耗标准状况下的5.6 L O2时,有__________mol电子发生转移。
(4)开始放电时,正极附近溶液的pH__________(填“增大”、“减小”或“不变”);
(5)溶液中H+由___________区向__________区移动(填“正极”或“负极”)。
(1) ;分子式 C2H6O (各1分)
;分子式 C2H6O (各1分)
(2)C2H6O -12e- +3H2O =12H+ +2CO2 ↑ (3分) (3) 1 (1分)
(4)增大 (1分) (5) 负极 正极 ( 各1分)
解析试题分析:(1)某物质A的产量可以用来衡量一个国家的石油化工发展水平,可知A为乙烯, 电子式为 ;与水加成的产物B是一种常用的有机溶剂,则B为乙醇。则答案为分子式 C2H6O 。
;与水加成的产物B是一种常用的有机溶剂,则B为乙醇。则答案为分子式 C2H6O 。
(2)若用B与O2制成燃料电池,并以稀硫酸溶液为电解质溶液,由乙醇燃料电池发生的氧化还原反应可知乙醇失去电子,则在负极上发生失电子反应C2H6O -12e- +3H2O =12H+ +2CO2 ↑ 。(3)根据电子守恒,当消耗5.6 L O2时,即0.25mol氧气反应了,转移1mol电子。(4)开始放电时,正极反应中有氢离子参加了反应,故附近溶液的pH增大。(5)溶液中H+由负极区向正极区移动。
考点:本题考查了电子式和原电池电极反应式的书写。

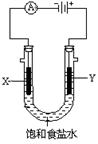
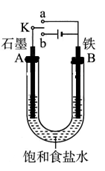
为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。

I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填序号)。
| A.石墨 | B.镁 | C.银 | D.铂 |
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极溶液的pH (填“增大”“减小”或“不变”)
(4)电解过程中,Y极发生的电极反应为4OH?-4e?=2H2O+O2↑和 。
(5)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为 mL(均已折算为标准状况时气体体积)。
(6)K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应为:
2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为 。
某研究性学习小组欲探究原电池的形成条件,按下图所示装置进行实验
| 序号 | A | B | 烧杯中的液体 | 指针是否偏转 |
| 1 | Zn | Cu | 稀硫酸 | 有 |
| 2 | Zn | Zn | 稀硫酸 | 无 |
| 3 | Cu | C | 氯化钠溶液 | 有 |
| 4 | Mg | Al | 氢氧化钠溶液 | 有 |
分析上述数据,回答下列问题:
(1)实验1中由A极流向B极的是 (填“电流”或“电子”);
(2)实验4中电子由B极流向A极,表明负极是 电极(填“镁”或“铝”);电极反应式为: ;
(3)实验3表明 (选填序号);
①铜在潮湿空气中不会被腐蚀 ②铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是 (选填序号)。
①相对活泼的金属一定做负极
②失去电子的电极是负极
③烧杯中的液体,必须是电解质溶液
④浸入同一电解质溶液中的两个电极,是活泼性不同的二种金属(或其中一种能导电的非金属)




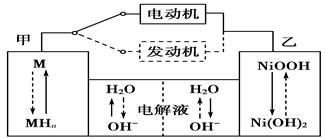
 2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,甲电
2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,甲电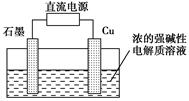
 Cu2O+H2↑,阴极的电极反应式是_____________________。
Cu2O+H2↑,阴极的电极反应式是_____________________。