题目内容
【题目】已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:3Cu+8HNO3(稀) =3Cu(NO3)2+2NO↑+4H2O
(1)氧化剂是_______,发生氧化反应的物质是__________,被氧化的元素是_______,还原产物是___________.
(2)生成1molNO转移电子_____mol
(3)用单线桥法表示反应电子得失的方向和数目:_____________
【答案】HNO3 Cu Cu NO 3 ![]()
【解析】
反应中硝酸中的N原子化合价降低,则硝酸作氧化剂,发生还原反应,NO为还原产物;Cu的化合价升高,作还原剂,被氧化,发生氧化反应生成氧化产物。
(1)反应中硝酸中的N原子化合价降低,则硝酸作氧化剂,发生还原反应,NO为还原产物;Cu的化合价升高,作还原剂,被氧化,发生氧化反应的物质为Cu;
(2)硝酸中的N原子化合价由+5变为+2价,得到3个电子,则生成1molNO转移3mol电子;
(3)反应中Cu化合价由0价变为+2价,失电子6e,硝酸中的N原子得电子,则单线桥法表示为![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】地球上的氮元素对动植物有重要作用,其中氨的合成与应用是当前的研究热点。
(1)不同温度下工业合成氨N2(g)+3H2(g)![]() 2NH3(g)反应的部分K值如下表。
2NH3(g)反应的部分K值如下表。
温度/℃ | 25 | 400 | 450 |
K | 5×108 | 0.507 | 0.152 |
①工业合成氨反应平衡常数表达式为K=___。
②请结合平衡常数解释,该反应为放热反应的理由___。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因___。
(2)科学家利用电解法在常温常压下实现合成氨,工作时阴极区的微观示意图如图,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。
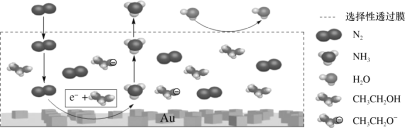
①阴极区生成NH3的电极方程式为___。
②下列说法不正确的是___(填字母序号)。
a.三氟甲磺酸锂的作用是增强导电性
b.该装置用金(Au)作催化剂目的是降低N2的键能
c.选择性透过膜可允许N2和NH3通过,防止H2O进入装置