题目内容
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。磷酸铁锂电池充电时阳极反应式为:LiFePO4 -xLi+ -xe-→ xFePO4 + (1-x)LiFePO4。放电工作示意图如下图。下列叙述不正确的是

A.放电时,Li+ 通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为:FePO4 + xLi+ + xe-→ xLiFePO4 + (1-x)FePO4
D.该电池充放电过程通过Li+ 迁移实现,C、Fe、P元素化合价均不发生变化
【答案】D
【解析】
A.原电池放电时,电解质溶液中阳离子向正极移动,则Li+ 通过隔膜移向正极,A正确;
B.原电池放电时,电子由负极铝箔流出,沿导线流向正极铜箔,B正确;
C.原电池放电时,正极、负极反应式正好与阳极、阴极反应式相反,所以正极反应为:FePO4 + xLi+ + xe-→ xLiFePO4 + (1-x)FePO4,C正确;
D.由于隔膜的作用,Li+ 通过隔膜形成闭合回路,完成电池的充放电,电池的总反应为:xFePO4 +LixC6![]() xLiFePO4+6C,其中Fe的化合价发生变化,C、P元素化合价不变,D错误。
xLiFePO4+6C,其中Fe的化合价发生变化,C、P元素化合价不变,D错误。
答案选D。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%
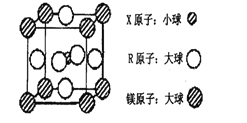
【题目】X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为:I1=578KJ·mol-1I2=1817KJ·mol-1I3=2745KJ·mol-1 I4=11575KJ·mol-1I5=14830KJ·mol-1I6=18376KJ·mol-1 |
Q为前四周期中电负性最小的元素 |
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子中未成对电子数为______;X、Y、Z三种元素原子的第一电离能由小到大的顺序为____________(用元素符号表示)。
(2)W的氯化物的熔点比Q的氯化物的熔点__________(填“高”或“低”),理由是__________________________________________________。
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)_____________。
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_______;晶体中每个镁原子周围距离最近的R原子有_______个。