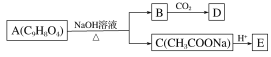
题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.28g聚乙烯中含有NA个碳碳双键
B.1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗Cl2分子数最多为6 NA
C.标准状况下,2.24L CCl4中的原子总数大于0.5 NA
D.17g羟基中含有的电子数为10 NA
【答案】C
【解析】
A.聚乙烯(![]() )中不含碳碳双键,故A错误;
)中不含碳碳双键,故A错误;
B.1 mol乙烯可与1molCl2完全加成生成C2H4Cl2,然后再与Cl2发生取代反应,共消耗4mol氯气,消耗氯气的物质的量最多为5mol,则消耗Cl2分子数最多为5NA,故B错误;
C.标准状况下,CCl4为液态,2.24 L CCl4的物质的量大于0.1mol,原子总数大于0.5NA,故C正确;
D.一个羟基中含有9个电子,17g羟基的物质的量为![]() =1mol,其中含有的电子数为1mol×9×NA/mol=9NA,故D错误;
=1mol,其中含有的电子数为1mol×9×NA/mol=9NA,故D错误;
答案选C。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案【题目】表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )
A | B | C | ||
D | ||||
A.原子半径大小比较为D>C>B>A
B.生成的氢化物分子间均可形成氢键
C.A与C形成的阴离子可能有AC![]() 、A2C
、A2C![]()
D.A、B、C、D的单质常温下均不导电
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O 4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是__________。
(2)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填序号)。
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
(3)0.1 molL-1的H2C2O4溶液与0.1 molL-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa______NaClO,两溶液中:[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(5)向0.1 molL-1CH3COOH 溶液中滴加 NaOH 溶液至 c(CH3COOH): c(CH3COO-)=5 : 9,此时溶液pH=_______________。
【题目】如图是元素周期表的一部分,其中X、Y、Z均为短周期元素,它们的位置关系如图所示,已知三种元素的质子数之和为31,写出:
X | ||
Y | Z |
(1)写出X、Y、Z的元素符号:___、___、___。
(2)写出Y元素的离子结构示意图:___。
(3)元素Y和Z的金属性较强的是___(填元素符号)。
(4)Z是大自然赐予人类的宝物。它其中的一个用途是和氧化铁反应制得难熔金属铁,该反应的化学方程式为___,Z表现出的性质是___(氧化性/还原性),反应时可观察到的实验现象有___(填字母)。
A.产生红棕色烟雾 B.发出耀眼的光芒 C.有熔融物生成