题目内容
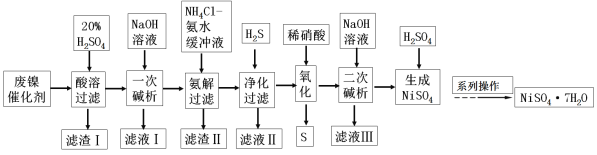
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如下:
已知:① NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl—氨水的混合液,Ni(OH)2溶于NH4Cl—氨水的混合液生成[Ni(NH3)6]2+。
③离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答下列问题:
(1)“酸溶”时应先将废镍催化剂粉碎,再与20%硫酸在100℃下反应2小时,该操作的目的为_____。
(2)“滤渣I”主要成分在工业上的用途为___(只写1种即可),NH4Cl的电子式为_____。
(3)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为____。
(4)“氨解”的目的为________, “净化”时加入的H2S的目的是将镍元素转化为NiS沉淀,对应的离子方程式为:________。
(5)“氧化”时发生反应的离子方程为________。
(6)“二次碱浸”时,若使溶液中的Ni2+沉淀完全,则需维持c(OH-)不低于____。(已知Ni(OH)2的Ksp=2×10-15,![]() ≈1.4)。
≈1.4)。
(7)工业上利用电解法处理含氯化镍的酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是________。
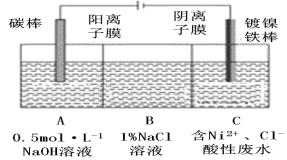
已知:①Ni2+在弱酸性溶液中发生水解;
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)。
A.碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减小
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
【答案】加快反应速率,提高镍元素的浸出率 制玻璃或制光导纤维 ![]() Cr3++4OH-=CrO2-+2H2O 实现镍元素和铁元素的分离 [Ni(NH3)6]2++H2S=NiS↓+2NH4++4NH3↑ 3NiS+8H++2NO3-=3Ni2++2NO↑+3S↓+4H2O 1.4×10-5mol·L-1 B
Cr3++4OH-=CrO2-+2H2O 实现镍元素和铁元素的分离 [Ni(NH3)6]2++H2S=NiS↓+2NH4++4NH3↑ 3NiS+8H++2NO3-=3Ni2++2NO↑+3S↓+4H2O 1.4×10-5mol·L-1 B
【解析】
废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)
经酸溶得到硫酸镍、硫酸铁、硫酸铬溶液,二氧化硅不溶于酸为滤渣Ⅰ的主要成分;向滤液中加入氢氧化钠溶液得到氢氧化镍沉淀、氢氧化铁沉淀、偏铬酸钠溶液,偏铬酸钠溶液为滤液Ⅰ的主要成分;向沉淀中加入NH4Cl—氨水的混合液,氢氧化铁沉淀不溶于此溶液,为滤渣Ⅱ的主要成分,氢氧化镍沉淀溶于此溶液得到[Ni(NH3)6]2+溶液;向溶液中通入H2S,生成NiS沉淀;向沉淀中滴入稀硝酸得到硝酸镍;向硝酸镍中加入氢氧化钠溶液得到氢氧化镍沉淀;向沉淀中加入硫酸得到硫酸镍;在经过系列操作得到NiSO4·7H2O。据此解答。
(1)“酸溶”时应先将废镍催化剂粉碎,再与20%硫酸在100℃下反应2小时,是为了增大接触面积,加快反应速率,提高镍元素的浸出率。本小题答案为:加快反应速率,提高镍元素的浸出率。
(2)二氧化硅不溶于稀硫酸,则“滤渣I”主要成分是二氧化硅, 二氧化硅主要应用于制玻璃或制光导纤维;NH4Cl中即含离子键又含共价键,是离子化合物,电子式为![]() 。本小题答案为:制玻璃或制光导纤维;
。本小题答案为:制玻璃或制光导纤维;![]() 。
。
(3)根据信息可知,Cr(OH)3是两性氢氧化物,性质类似于氢氧化铝,铬离子与少量氢氧化钠反应生成氢氧化铬,若氢氧化钠过量,则过量的氢氧化钠与氢氧化铬继续反应生成偏铬酸钠,故“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为Cr3++4OH-=CrO2-+2H2O。本小题答案为:Cr3++4OH-=CrO2-+2H2O。
(4)废镍催化剂中的铁元素在“一次碱析”时转化为氢氧化铁,由于Fe(OH)3不溶于NH4Cl—氨水的混合液,Ni(OH)2溶于NH4Cl—氨水的混合液生成[Ni(NH3)6]2+,则 “氨解”的目的是实现镍元素和铁元素的分离;“净化”时加入H2S,H2S与[Ni(NH3)6]2+发生反应生成NiS沉淀,离子方程式为[Ni(NH3)6]2++H2S=NiS↓+2NH4++4NH3↑。本小题答案为:实现镍元素和铁元素的分离;[Ni(NH3)6]2++H2S=NiS↓+2NH4++4NH3↑。
(5)“氧化”时发生的反应是稀硝酸和NiS的反应,根据流程图反应生成S,则稀硝酸中的氮元素由+5价降低到+2价生成NO,NiS中的硫元素由-2价升高到0价生成S单质,根据得失电子守恒、电荷守恒和原子守恒,反应的离子方程式为3NiS+8H++2NO3-=3Ni2++2NO↑+3S↓+4H2O。本小题答案为:3NiS+8H++2NO3-=3Ni2++2NO↑+3S↓+4H2O。
(6)氢氧化镍中存在溶解平衡,![]() 。根据信息离子浓度≤10-5mol·L-1时,离子沉淀完全,则
。根据信息离子浓度≤10-5mol·L-1时,离子沉淀完全,则![]() ,c(OH-)=1.4×10-5mol·L-1, 则若使溶液中的Ni2+沉淀完全,需维持c(OH-)不低于1.4×10-5mol·L-1。本小题答案为:1.4×10-5mol·L-1。
,c(OH-)=1.4×10-5mol·L-1, 则若使溶液中的Ni2+沉淀完全,需维持c(OH-)不低于1.4×10-5mol·L-1。本小题答案为:1.4×10-5mol·L-1。
(7)A. 由图知,碳棒与电源正极相连是电解池的阳极,电极反应4OH4e=2H2O+O2↑,故A正确;
B. 镀镍铁棒与电源负极相连是电解池的阴极,电极反应Ni2++2e=Ni,电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl分别通过阳离子膜和阴离子膜移向B中,这使B中NaCl溶液的物质的量浓度不断增大,故B错误;
C. 因Ni2+在弱酸性溶液中易发生水解;氧化性Ni2+(高浓度)>H+>Ni2+(低浓度),为了提高Ni的产率,电解过程中需要控制废水pH,故C正确;
D. 若将图中阳离子膜去掉,由于放电顺序Cl>OH,则Cl移向阳极放电:2Cl 2e=Cl2↑,电解反应总方程式会发生改变,故D正确。答案选B。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案