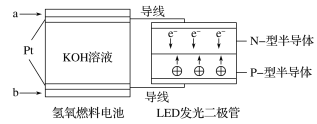
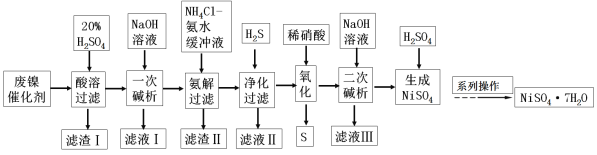
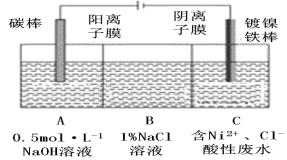
题目内容
【题目】一定量的某有机物完全燃烧后,将燃烧产物通过足量的石灰水,经过滤可得沉淀10g,但称量滤液时,其质量只比原石灰水减少2.9g,则此有机物可能是:
A. C2H4 B. C2H4O2
C. C2H6O D. C4H10O
【答案】C
【解析】
有机物燃烧产物有二氧化碳和水,将燃烧产物通过足量的石灰水,经过滤可得沉淀10g,沉淀应为CaCO3,根据方程式:CO2+Ca(OH)2===CaCO3↓+H2O,可计算发生反应导致滤液减少的质量,称量滤液时,其质量只比原石灰水减少2.9g,根据质量守恒再计算有机物燃烧生成水的质量,以此解答该题。
有机物燃烧产物有二氧化碳和水,将燃烧产物通过足量的石灰水,经过滤可得沉淀10g,沉淀应为CaCO3,根据碳原子守恒可知n(CO2)=n(CaCO3)=![]() =0.1mol,故该有机物中碳原子为0.1mol;
=0.1mol,故该有机物中碳原子为0.1mol;
根据方程式:CO2+Ca(OH)2===CaCO3↓+H2O 滤液减少的质量△m
74g 100g 18g 56g
10g 5.6g
称量滤液时,其质量只比原石灰水减少2.9g,则有机物燃烧生成水的质量应为5.6g2.9g=2.7g,则n(H)=2n(H2O)=![]() =0.3mol,则有机物中N(C):N(H)=1:3,只有C项符合,故答案为C。
=0.3mol,则有机物中N(C):N(H)=1:3,只有C项符合,故答案为C。

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目