题目内容
17.下列离子方程式正确的是( )| A. | 乙酸与碳酸钠溶液反应:2H++CO${\;}_{3}^{2-}$═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-→CH3COO-+H2O | |
| C. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$ CO${\;}_{3}^{2-}$+2NH${\;}_{4}^{+}$+4Ag↓+6NH3+2H2O | |
| D. | 苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+CO32- |
分析 A.乙酸为弱酸,离子方程式中乙酸不能拆开,需要保留分子式;
B.氢氧化铜为难溶物,离子方程式中氢氧化铜不能拆开;
C.甲醛分子中相当于含有2个醛基,1mol甲醛完全反应能够置换出4mol银;
D.苯酚的酸性大于碳酸氢根离子,二者反应生成苯酚和碳酸氢根离子.
解答 解:A.CH3COOH为弱酸,在离子方程式中应写成化学式,其正确的离子方程式为:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO-,故A错误;
B.醋酸溶液与新制氢氧化铜反应,正确的离子方程式:2CH3COOH+Cu(OH)2→2CH3COO-+2H2O+Cu2+,故B错误;
C.醛溶液与足量的银氨溶液共热的离子反应为:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O,故C正确;
D.苯酚钠溶液中通入少量二氧化碳,反应生成碳酸氢钠和苯酚,正确的离子方程式为:C6H5O-+CO2+H2O→C6H5OH+HCO3-,故D错误;
故选C.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;D为易错点,注意反应生成的是碳酸氢钠.

练习册系列答案
相关题目
12.化学家们合成了如图所示的一系列的星烷,如三星烷、四星烷、五星烷等.下列说法正确的是( )
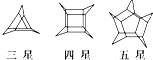

| A. | 它们之间互为同系物 | |
| B. | 六星烷的化学式为C18H23 | |
| C. | 三星烷与丙苯互为同分异构体,四星烷与 互为同分异构体 互为同分异构体 | |
| D. | 它们的一氯代物均只有3种 |
5.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱.下列反应在水溶液中不可能发生的是( )
| A. | 2Fe3++2I-═2Fe2++I2 | B. | Cl2+FeI2═FeCl2+I2 | ||
| C. | Co2O3+6HCl═2CoCl2+Cl2+3 H2O | D. | 3 Cl2+6 FeI2═2FeCl3+4FeI3 |
9.A和B是前三周期的元素,它们的离子A2+和B3+具有相同的核外电子层结构,下列说法正确的是( )
| A. | 原子半径:A>B | B. | 原子序数:A>B | ||
| C. | 离子半径:A2+<B3+ | D. | 质量数:A>B |
7.(1)到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g+2H2O (l)△H=-704 KJ/mol.
(2)铜单质及其化合物在工业生产和科研中有重要作用.现用氯化铜晶体(CuCl2•2H2O,含氯化亚铁杂质)制取纯净的CuCl2•2H2O.先将其制成水溶液,后按如图步骤进行提纯:
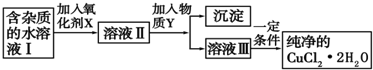
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表
请回答下列问题:
①现有氧化剂NaClO、H2O2、KMnO4,X加哪种好?H2O2好,不引入杂质离子;该反应的离子方程式为H2O2+2Fe2++2H+═2Fe3++2H2O.
②溶液II中除Cu2+外,还有Fe3+金属离子,如何检验其存在取少量溶液于试管中,滴加KSCN溶液,若溶液.变为血红色,则说明有Fe3+,若溶液不变为血红色则说明没有Fe3+.
③物质Y不能为下列的ef
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3 e.CaO f.NaOH
④若向溶液Ⅱ中加入碳酸钙,产生的现象是碳酸钙溶解,产生气泡和红褐色沉淀.
(2)铜单质及其化合物在工业生产和科研中有重要作用.现用氯化铜晶体(CuCl2•2H2O,含氯化亚铁杂质)制取纯净的CuCl2•2H2O.先将其制成水溶液,后按如图步骤进行提纯:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表
| 金属离子 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
①现有氧化剂NaClO、H2O2、KMnO4,X加哪种好?H2O2好,不引入杂质离子;该反应的离子方程式为H2O2+2Fe2++2H+═2Fe3++2H2O.
②溶液II中除Cu2+外,还有Fe3+金属离子,如何检验其存在取少量溶液于试管中,滴加KSCN溶液,若溶液.变为血红色,则说明有Fe3+,若溶液不变为血红色则说明没有Fe3+.
③物质Y不能为下列的ef
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3 e.CaO f.NaOH
④若向溶液Ⅱ中加入碳酸钙,产生的现象是碳酸钙溶解,产生气泡和红褐色沉淀.


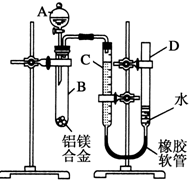 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.