题目内容
20. 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.阴极的反应式是:H2O+2e-═H2↑+O2-,CO2+2e-═CO+O2-;阳极的反应式是:2H2O-4e-═O2↑+4H+.总反应可表示为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2.
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.阴极的反应式是:H2O+2e-═H2↑+O2-,CO2+2e-═CO+O2-;阳极的反应式是:2H2O-4e-═O2↑+4H+.总反应可表示为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2.
分析 电解池阴极发生还原反应,阳极发生氧化反应,阴极反应式和阳极反应联立消去电子可以得到总反应方程式,根据反应物结合化合价的变化分析.
解答 解:电解池阴极发生还原反应,电解H2O-CO2混合气体制备H2和CO,阴极:水中的氢原子得到电子生成氢气,H2O+2e-═H2↑+O2-,二氧化碳得到电子生成一氧化碳,CO2+2e-═CO+O2-,电解池阳极发生氧化反应,电解H2O-CO2混合气体制备H2和CO,阳极:水失去电子生成氧气气,2H2O-4e-═O2↑+4H+,总反应为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2,
故答案为:H2O+2e-═H2↑+O2-,CO2+2e-═CO+O2-;2H2O-4e-═O2↑+4H+;H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2.
点评 本题考查电解知识,为高频考点,侧重于考查学生的综合运用能力,注意基础知识的积累掌握,掌握电解池阳极发生氧化反应,阴极发生还原反应为解答关键.题目难度中等,是中档题.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
19.下列反应的离子方程式不正确的是( )
| A. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu | |
| B. | 氢氧化钠与盐酸反应:OH-+H+═H2O | |
| C. | 氢氧化钡与硫酸反应:Ba2++SO42+═BaSO4↓ | |
| D. | 铁与稀盐酸反应:Fe+2H+═Fe2++H2↑ |
20.下列关于有机物的说认正确的是( )
| A. | 丙烯和聚丙烯的组成和性质相同 | B. | 乙酸制乙酸甲酯属于加成反应 | ||
| C. | 苯和环己烷的二氯代物都有3种 | D. | 乙醇浸泡中草药时作溶剂 |
15.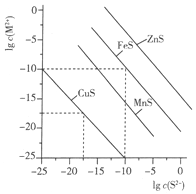 一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列有关判断不正确的是( )
一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列有关判断不正确的是( )
 一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列有关判断不正确的是( )
一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列有关判断不正确的是( )| A. | 该温度下,Ksp(MnS)大于1.0×10-35 | |
| B. | 向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,Mn2+最有可能先沉淀 | |
| C. | 向c(Fe2+)=0.1mol•L-1的溶液中加入CuS粉末,有FeS沉淀析出 | |
| D. | 该温度下,溶解度:CuS>MnS>FeS>ZnS |
5.回答下列相关问题:
(1)用“>”或“<”填写表:
(2)某半导体材料由X、Y两种元素组成,已知X的基态原子4p轨道上只有1个电子,Y的基态原子L层上有3个未成对电子.X位于周期表第四周期IIIA族;该半导体材料的化学式为GaN
(3)由极性共价键构成的非极性分子是d(填序号).
a.P4b.COS c.CH3OCH3 d.BCl3
(4)雷氏盐(Reinecke's salt)结构式如图所示:
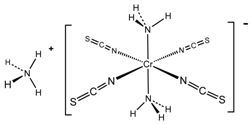
配离子中Cr3+的配体为NH3和NCS-(填化学式),Cr3+与配体间形成的共价键又称为配位键.
(1)用“>”或“<”填写表:
| 电负性 | 第一电离能 | 熔点 | 沸点(同压) | 在水中溶解性 |
| C>H | S<P | NaF>KCl | PH3<NH3 | CH3OH>CH3SH |
(3)由极性共价键构成的非极性分子是d(填序号).
a.P4b.COS c.CH3OCH3 d.BCl3
(4)雷氏盐(Reinecke's salt)结构式如图所示:

配离子中Cr3+的配体为NH3和NCS-(填化学式),Cr3+与配体间形成的共价键又称为配位键.
9.古代的很多谚语都蕴含着科学知识.下列对谚语的解释正确的是( )
| A. | “甘之如饴”说明糖类均有甜味 | |
| B. | “玉不琢不成器”“百炼方能成钢”发生的都是化学变化 | |
| C. | “火树银花”中的焰火实质上是金属元素的焰色反应 | |
| D. | “冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高 |