题目内容
12.如图是元素周期表的一部分,表中所列字母分别代表一种元素
回答下列问题:
(1)h元素的名称是溴,九种元素中金属性最强的是Na (填元素符号)
(2)f的最高价氧化物对应的水化物的化学式NaOH(填化学式)
(3)b、c、d、e的原子半径依次减小(填增大或减小)
(4)e、h元素的氢化物中,热稳定性大的是HF(填氢化物的化学式)
(5)化合物f2d2与化合物 a2d反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑
(6)工业上冶炼g元素的单质的化学方程式2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
分析 由图可知,a为H,b为C,c为N,d为O,e为F,f为Na,g为Al,h为Br,i为Kr,
(1)h为Br,只有Na、Al为金属,同周期从左向右金属性减弱;
(2)f的最高价氧化物对应的水化物为氢氧化钠;
(3)同周期从左向右原子半径减小;
(4)非金属性越强,对应氢化物越稳定;
(5)f2d2与化合物 a2d反应反应生成NaOH和氧气;
(6)电解熔融氧化铝冶炼Al.
解答 解:(1)h为Br,名称为溴,只有Na、Al为金属,同周期从左向右金属性减弱,则九种元素中金属性最强的是Na,
故答案为:溴;Na;
(2)f的最高价氧化物对应的水化物为氢氧化钠,化学式为NaOH,故答案为:NaOH;
(3)同周期从左向右原子半径减小,则b、c、d、e的原子半径依次减小,故答案为:减小;
(4)非金属性越强,对应氢化物越稳定,e、h元素的氢化物中,热稳定性大的是HF,故答案为:HF;
(5)f2d2与化合物 a2d反应反应生成NaOH和氧气,离子反应为2Na2O2+2H2O=4Na ++4OH-+O2↑,故答案为:2Na2O2+2H2O=4Na ++4OH-+O2↑;
(6)电解熔融氧化铝冶炼Al,化学方程式为2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,故答案为:2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的性质、元素化合物知识、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
11.用下列实验装置进行相应的实验,能达到实验目的是( )
| A. |  用于实验室制氨气并收集干燥的氨气 | |
| B. |  用于除去CO2中含有的少量HC1 | |
| C. |  用于提取I2的CCl4溶液中的I2 | |
| D. | 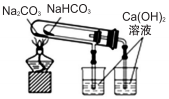 装置用于验证NaHCO3和Na2CO3的热稳定性 |
3.常温下,Ksp[Mg(OH)2]=1.1×10-11,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,下列叙述不正确的是( )
| A. | 浓度均为2×10-5mol•L-1的AgNO3溶液和NaCl溶液等体积混合,有白色沉淀产生 | |
| B. | 将0.001mol•L-1的AgNO3溶液滴入0.001mol•L-1的KCl和K2CrO4的混合溶液中,先产生AgCl沉淀 | |
| C. | c(Mg2+)为0.11mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 其他条件不变,向饱和Ag2CrO4水溶液中加入少量K2CrO4溶液,溶液中c(Ag+)减小 |
7.下表是元素周期表一部分,列出了九种元素在周期表中的位置:
请用化学用语回答下列问题
(1)在上述元素中,金属性最强的是Na.
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式).写出⑥和⑧的最高价氧化物对应的水化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)只由④形成的18电子微粒.O22-.
(4)写出②的最高价氧化物的电子式 .
.
(5)用电子式表示⑦和⑨形成的化合物的形成过程 .
.
(6)表中元素③和⑤可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式F-N=N-F.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在上述元素中,金属性最强的是Na.
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式).写出⑥和⑧的最高价氧化物对应的水化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)只由④形成的18电子微粒.O22-.
(4)写出②的最高价氧化物的电子式
 .
.(5)用电子式表示⑦和⑨形成的化合物的形成过程
 .
.(6)表中元素③和⑤可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式F-N=N-F.
17.如表是元素周期表的一部分,用化学用语回答:
(1)②的元素符号为F.
(2)比较元素③和⑦的原子半径大小:③<⑦(填“>”或“<”).
(3)绘出元素⑤的离子结构示意图 .
.
(4)元素①的氢化物的电子式为 ,将该氢化物通入④和⑥形成的化合物的水溶液中,发生反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,将该氢化物通入④和⑥形成的化合物的水溶液中,发生反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ] | ① | ② | ||||
| 三 | ③ | ④ | ⑤ | ⑥ | |||
| 四 | ⑦ |
(2)比较元素③和⑦的原子半径大小:③<⑦(填“>”或“<”).
(3)绘出元素⑤的离子结构示意图
 .
.(4)元素①的氢化物的电子式为
 ,将该氢化物通入④和⑥形成的化合物的水溶液中,发生反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,将该氢化物通入④和⑥形成的化合物的水溶液中,发生反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
4.(NH4) 2SO4在一定条件下发生如下反应:4(NH4) 2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应.下列说法正确的是( )
| A. | 生成的沉淀是BaSO4 | |
| B. | 生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:1 | |
| C. | 生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为l:3 | |
| D. | 从溶液中逸出的气体只有N2,最后留下溶液中溶质是NH4C1 |
1.在给定条件的水溶液中不能大量共存的粒子组是( )
| A. | 通有CO2的溶液:K+、Ca2+、Cl-、NO3- | |
| B. | 既能溶解Al(OH)3又能溶解H2SiO3的溶液中:Na+、CO32-、ClO-、NO3- | |
| C. | 含Fe3+的溶液:Na+、Mg2+、NO3-、I- | |
| D. | CH3COOH溶液:SO42-、Cl-、Cu2+、NH4+ |
 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.阴极的反应式是:H2O+2e-═H2↑+O2-,CO2+2e-═CO+O2-;阳极的反应式是:2H2O-4e-═O2↑+4H+.总反应可表示为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2.
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.阴极的反应式是:H2O+2e-═H2↑+O2-,CO2+2e-═CO+O2-;阳极的反应式是:2H2O-4e-═O2↑+4H+.总反应可表示为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2.