题目内容
19.下列反应的离子方程式不正确的是( )| A. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu | |
| B. | 氢氧化钠与盐酸反应:OH-+H+═H2O | |
| C. | 氢氧化钡与硫酸反应:Ba2++SO42+═BaSO4↓ | |
| D. | 铁与稀盐酸反应:Fe+2H+═Fe2++H2↑ |
分析 A.反应生成硫酸锌和Cu;
B.反应生成氯化钠和水;
C.漏写生成水的离子反应;
D.反应生成氯化亚铁和氢气.
解答 解:A.锌与硫酸铜溶液反应的离子反应为Zn+Cu2+═Zn2++Cu,遵循电子、电荷守恒,故A正确;
B.氢氧化钠与盐酸反应的离子反应为OH-+H+═H2O,故B正确;
C.氢氧化钡与硫酸反应的离子反应为2OH-+2H++Ba2++SO42+═BaSO4↓+2H2O,故C错误;
D.Fe与稀盐酸反应的离子反应为Fe+2H+═Fe2++H2↑,遵循电子、电荷守恒,故D正确;
故选C.
点评 本题考查离子方程式的书写,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒的判断,题目难度不大.

练习册系列答案
相关题目
9.关于化学式[TiCl( H2O)5]Cl2•H2O 的配合物的下列说法中正确的是( )
| A. | 配位体是 Cl-和 H2 O,配位数是8 | |
| B. | 中心离子是 Ti4+,配离子是[TiCl(H2 O)5]2+ | |
| C. | 内界和外界中的 Cl-的数目比是 1:2 | |
| D. | 在 1mol 该配合物中加入足量 AgNO3 溶液,可以得到 3molAgCl 沉淀 |
10.在下列条件下,一定能大量共存的微粒组是( )
| A. | 常温下,水电离的c(H+)=1×10-14mol/L的溶液中:K+、Na+、AlO2-、SiO32- | |
| B. | 使甲基橙变红的溶液中:Na+、Fe3+、NO3-、SO32- | |
| C. | 常温下,在$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液中:K+、Ba2+、NO3-、I- | |
| D. | 中性的溶液中:CO32-、Na+、SO42-、AlO2- |
7.下列有关有机物结构、性质的说法正确的是( )
| A. | 甲烷和苯都没有同分异构体 | |
| B. | 甲苯( )的分子中所有碳原子在同一平面上 )的分子中所有碳原子在同一平面上 | |
| C. | 苯和乙烯都能使溴水褪色,均与溴水发生加成反应 | |
| D. | 乙烯在工业上主要通过石油分馏得到 |
14.下列离子反应方程式中,错误的是( )
| A. | 将氨通入盐酸中:NH3+H+═NH4+ | |
| B. | 在NaOH溶液中滴入几滴NH4CI溶液并加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将少量铜粉放入浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
4.医院里检验糖尿病的方法是:将病人尿液加入到CuSO4和NaOH的混合液中,加热后若产生红色沉淀,则说明病人的尿液中含有( )
| A. | 葡萄糖 | B. | 乙酸 | C. | 蛋白质 | D. | 脂肪 |
11.用下列实验装置进行相应的实验,能达到实验目的是( )
| A. |  用于实验室制氨气并收集干燥的氨气 | |
| B. |  用于除去CO2中含有的少量HC1 | |
| C. |  用于提取I2的CCl4溶液中的I2 | |
| D. | 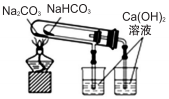 装置用于验证NaHCO3和Na2CO3的热稳定性 |
 甲醇是一种优质燃料,在工业上常用
甲醇是一种优质燃料,在工业上常用 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.阴极的反应式是:H2O+2e-═H2↑+O2-,CO2+2e-═CO+O2-;阳极的反应式是:2H2O-4e-═O2↑+4H+.总反应可表示为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2.
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.阴极的反应式是:H2O+2e-═H2↑+O2-,CO2+2e-═CO+O2-;阳极的反应式是:2H2O-4e-═O2↑+4H+.总反应可表示为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2.