��Ŀ����
����Ŀ�������仯�����������������й㷺Ӧ�á�
��1����֪��CO�ɽ����ֵ��������ﻹԭΪN2��
��Ӧ����2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
��Ӧ����4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
д��CO��NO2��ԭΪNO���Ȼ�ѧ����ʽ ��
��2����һ���Ⱥ��ݵ������г���2mol CO��1mol NO2����������ӦII��������˵����Ӧ�ﵽƽ��״̬���� �� ��
A�������ڵ���ѹǿ���ڱ仯 B��������CO��NO2���ʵ����Ȳ���
C������������ƽ���ܶȲ��� D�������������¶Ⱥ㶨����
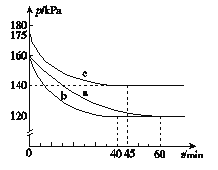
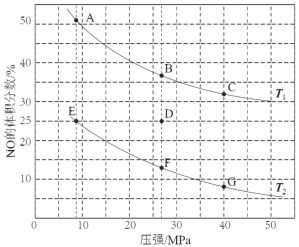
��3�����ܱ������г���5 mol CO��4 mol NO����������ӦI����ͼΪƽ��ʱNO������������¶ȡ�ѹǿ�Ĺ�ϵ��
�ش��������⣺
���¶ȣ�T1 T2����������� ����
��ij�¶��£������Ϊ2 L���ܱ������У���Ӧ����10���ӷų�����373 kJ����CO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(CO)= ��
������D��Է�Ӧ�������µ�ͬʱ�������ʹ��ϵѹǿ��С�����´ﵽ��ƽ��״̬������ͼ��A~G���е� ��
��4��ij�¶�ʱ����������AgNO2�� Ksp= 9.0��10-4��Ag2SO4��Ksp=4.0��10-5������NO2����SO42�������Һ�м���AgNO3��Һ��SO42��ǡ����ȫ��������SO42��Ũ�ȵ���1.0��10-5 mol��L-1��ʱ��c(NO2��)= mol��L��1��
��5������ͼ�������������£����ˮ��CN-��ת��ΪCO2��N2����д�������ĵ缫��Ӧʽ ��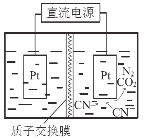
���𰸡���1��CO(g)+NO2(g)![]() CO2(g)+NO(g)��H=-227kJ��mol-1��
CO2(g)+NO(g)��H=-227kJ��mol-1��
��2��AD����3����������0.05mol��L-1��min-1����A��
��4��4.5��10��4mol��L��1����5��2CN��+4H2O��10e-��N2��+2CO2��+8H+��
��������
�����������1����2CO(g)+2NO(g) N2(g)+2CO2(g)����4CO(g)+2NO2(g) N2(g)+4CO2(g)��(������)/2�ó�CO(g)+NO2(g)![]() CO2(g)+ NO(g) ��H= -227 kJ��mol-1����2��A����Ӧǰ��ϵ��֮�Ͳ���ȣ����ѹǿ���䣬˵����Ӧ�ﵽƽ�⣬����ȷ��B����ΪͶ����Ϊ2��1����ϵ��֮����ȣ��κ�ʱ�̣����ʵ���֮�Ȳ��䣬����˵����Ӧ�ﵽƽ�⣬�ʴ���C�������ܶȵĶ��壬��ֶ������壬����������ȣ������Ǻ��ݣ�����������䣬����ܶȲ��䣬����˵���ﵽƽ�⣬�ʴ���D����Ϊ��������������Ӧ�Ƿ��ȷ�Ӧ���¶Ȼ����ߣ����¶Ȳ��ٸı䣬˵����Ӧ�ﵽƽ�⣬����ȷ��(3)������ѹ�ߣ�����Ӧ�Ƿ��ȷ�Ӧ���¶����ߣ�ƽ�����淴Ӧ�����ƶ���NO��ת���ʽ��ͣ�NO�������������T1>T2��������2molCO�ų�����Ϊ746kJ����˷ų�373kJ��������CO�����ʵ���Ϊ2��373/746mol=1mol�����ݻ�ѧ��Ӧ���ʵĶ��壬v(CO)= 1/(2��10) mol��L-1��min-1=0.05 mol��L-1��min-1���������¶ȣ�ƽ�����淴Ӧ�����ƶ���NO�������������Сѹǿ��ƽ�����淴Ӧ�����ƶ���NO�������������A�㣻(4)��SO42��ȫ��ת���ɳ�������ʱ��Һ��c2(Ag��)=Ksp/c(SO42��)=4����c(Ag��)=2mol��L��1�����c(NO2��)=Ksp/c(Ag��)=9��10��4/2mol��L��1=4.5��10��4mol��L��1��(5)������ʧ���ӵĹ��̣����ϼ����ߣ�����װ��ͼ���Ҳ�缫Ϊ���������缫��ӦʽΪ��2CN��+4H2O��10e-��N2��+2CO2��+8H+��
CO2(g)+ NO(g) ��H= -227 kJ��mol-1����2��A����Ӧǰ��ϵ��֮�Ͳ���ȣ����ѹǿ���䣬˵����Ӧ�ﵽƽ�⣬����ȷ��B����ΪͶ����Ϊ2��1����ϵ��֮����ȣ��κ�ʱ�̣����ʵ���֮�Ȳ��䣬����˵����Ӧ�ﵽƽ�⣬�ʴ���C�������ܶȵĶ��壬��ֶ������壬����������ȣ������Ǻ��ݣ�����������䣬����ܶȲ��䣬����˵���ﵽƽ�⣬�ʴ���D����Ϊ��������������Ӧ�Ƿ��ȷ�Ӧ���¶Ȼ����ߣ����¶Ȳ��ٸı䣬˵����Ӧ�ﵽƽ�⣬����ȷ��(3)������ѹ�ߣ�����Ӧ�Ƿ��ȷ�Ӧ���¶����ߣ�ƽ�����淴Ӧ�����ƶ���NO��ת���ʽ��ͣ�NO�������������T1>T2��������2molCO�ų�����Ϊ746kJ����˷ų�373kJ��������CO�����ʵ���Ϊ2��373/746mol=1mol�����ݻ�ѧ��Ӧ���ʵĶ��壬v(CO)= 1/(2��10) mol��L-1��min-1=0.05 mol��L-1��min-1���������¶ȣ�ƽ�����淴Ӧ�����ƶ���NO�������������Сѹǿ��ƽ�����淴Ӧ�����ƶ���NO�������������A�㣻(4)��SO42��ȫ��ת���ɳ�������ʱ��Һ��c2(Ag��)=Ksp/c(SO42��)=4����c(Ag��)=2mol��L��1�����c(NO2��)=Ksp/c(Ag��)=9��10��4/2mol��L��1=4.5��10��4mol��L��1��(5)������ʧ���ӵĹ��̣����ϼ����ߣ�����װ��ͼ���Ҳ�缫Ϊ���������缫��ӦʽΪ��2CN��+4H2O��10e-��N2��+2CO2��+8H+��

 ��������ϵ�д�
��������ϵ�д�