题目内容
【题目】某氯化亚铁和氯化铁的混合物.现要测定其中铁元素的质量分数,按如图步骤进行实验: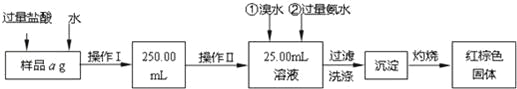
请根据以上流程,回答下列问题:
(1)样品溶解过程中加入少量浓盐酸的目的是什么?
操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有哪些仪器?
操作Ⅱ中可用的玻璃仪器是什么仪器?
(2)请写出加入氨水发生的离子反应方程式。
(3)沉淀洗涤的方法是什么?
(4)将沉淀物灼烧,冷却到室温,用天平称量其质量为b1g,再次灼烧并冷却至室温称量其质量为b2g,若b1﹣b2=0.3g,则接下来还应进行的操作是 .若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是 .
【答案】(1)抑制亚铁离子和铁离子的水解;胶头滴管和250mL容量瓶;酸式滴定管或移液管
(2)Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
(3)向过滤器中加蒸馏水至沉淀表面浸没,自然滤出,重复此操作2~3次
(4)继续加热,冷却至室温时,称量,直至两次连续称量质量差不超过0.1g;![]()
【解析】试题分析:(1)铁离子和亚铁离子均易水解,所以加入浓盐酸的作用是抑制亚铁离子和铁离子的水解;因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶,所以还需要的仪器有250mL容量瓶和胶头滴管;操作Ⅱ是量取25.00mL溶液,由于溶液显酸性,所以需要的仪器是酸式滴定管或移液管;
(2)溴水具有强氧化性,能把亚铁离子氧化生成铁离子,然后加入氨水沉淀铁离子,反应的离子方程式Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+。
(3)洗涤沉淀的方法是向过滤器中加蒸馏水至沉淀表面浸没,自然滤出,重复此操作2~3次;
(4)为了减少误差,需再次加热冷却并称量,直至两次质量差小于0.1g;因铁元素质量守恒,即红棕色固体中的铁就是样品中铁,Fe2O3中铁元素的质量为![]() 。
。

 口算能手系列答案
口算能手系列答案